题目内容
1.甲同学在0.5mol/L的FeCl3溶液中滴加0.1mol/LKI溶液即呈现红棕色,再加入CCl4振荡后静置,可观察到CCl4层呈紫色.乙同学在0.5mol/L的FeCl3溶液中先加入4mol/LNH4F溶液,发现FeCl3溶液渐渐褪至无色,而后再加入0.1mol/LKI溶液,不呈红棕色,再加CCl4振荡,静置,也观察不到CCl4层有紫红色出现.(1)甲同学的实验说明FeCl3溶液和KI溶液发生的反应,用离子方程式表示2Fe3++2I-=2Fe2++I2.
(2)乙同学在实验中观察不到甲同学的实验现象,其原因分析合理的是B.
A.Fe3+被F-还原成Fe2+,使溶液中不再存在Fe3+
B.Fe3+与F-结合成难电离物质,不再和I-反应
C.I-和F-或I-与NH4+结合成难电离物质,不再和Fe3+反应
(3)乙同学所用的NH4F溶液是用塑料瓶盛装的,可否改用玻璃试剂瓶否(填写能与否)其原因是氢氟酸会腐蚀玻璃.
分析 (1)FeCl3溶液中滴加KI溶液即呈现红棕色,再加入CCl4振荡后静置,可观察到CCl4层呈紫色,紫色的为碘单质,铁离子与碘离子反应生成了碘单质和亚铁离子;
(2)FeCl3溶液中先滴加NH4F溶液,发现FeCl3溶液渐渐褪至无色,而后再加入KI溶液,不呈红棕色,再加CCl4振荡,静置,也观察不到CCl4层有紫红色出现,则说明铁离子与氟离子结合生成难电离的物质;
(3)铵根离子水解生成HF,HF酸能与玻璃中的二氧化硅反应.
解答 解:(1)FeCl3溶液中滴加KI溶液即呈现红棕色,再加入CCl4振荡后静置,可观察到CCl4层呈紫色,生成碘,即铁离子与碘离子发生氧化还原反应,其离子反应为2Fe3++2I-=2Fe2++I2,
故答案为:2Fe3++2I-=2Fe2++I2;
(2)FeCl3溶液中先滴加NH4F溶液,发现FeCl3溶液渐渐褪至无色,而后再加入KI溶液,不呈红棕色,再加CCl4振荡,静置,也观察不到CCl4层有紫红色出现,则说明铁离子与氟离子结合生成难电离的物质,所以不能再与碘离子发生氧化还原反应,只有B符合,
故答案为:B;
(3)NH4F溶液中,铵根离子水解溶液显示酸性,发生反应为:NH4++H2O?NH3•H2O+HF,HF能与玻璃中的二氧化硅反应,所以不能用玻璃瓶盛放NH4F溶液,
故答案为:否;氢氟酸会腐蚀玻璃.
点评 本题考查盐的水解原理及其应用,题目难度中等,明确离子反应的实质是解答本题的关键,注意(2)中铁离子与氟离子结合生成难电离的物质为解答的难点,试题侧重考查学生的分析、理解能力.

练习册系列答案
相关题目
11.属于苯的同系物是( )
| A. | 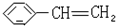 | B. | 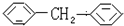 | C. |  | D. | 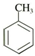 |
12.关于铯(Cs)及其化合物的性质,说法正确的是( )
| A. | 金属铯的熔点比金属钠高 | B. | CsOH比NaOH的碱性强 | ||
| C. | Cs与H2O能剧烈反应,但没有钠剧烈 | D. | 碳酸铯难溶于水 |
9.下列变化需克服相同类型作用力的是( )
| A. | 碘和干冰的升华 | B. | 硅和冰的熔化 | ||
| C. | 氯化氢和氯化钾的溶解 | D. | 氯化钠和冰融化 |
16.下列关于化学键的说法正确的是( )
| A. | 构成单质分子的微粒一定含有共价键 | |
| B. | 由非金属元素组成的化合物不一定是共价化合物 | |
| C. | 非极性键只存在于双原子分子中 | |
| D. | 含有共价键的化合物都是共价键化合物 |
6.下列表示物质结构的化学用语正确的是( )
| A. | 氯化氢的电子式: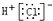 | B. | CO2的结构式:O=C=O | ||
| C. | 硫离子结构示意图: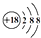 | D. | CCl4的电子式: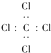 |
 O2
O2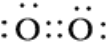 NH4+
NH4+ Na2O2
Na2O2
 CH4:
CH4: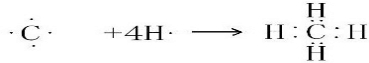 .
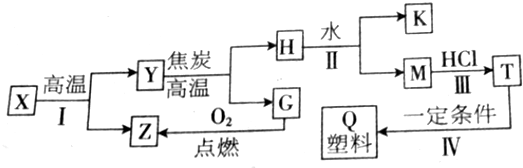
.

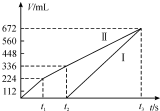 常温下用惰性电极电解200mLNaCl、CuSO4的混合溶液,所得气体的体积随时间变化如图所示,根据图中信息回答下列问题,(气体体积已换算成标准状况下的体积,且忽略气体在水中的溶解和溶液体积的变化)
常温下用惰性电极电解200mLNaCl、CuSO4的混合溶液,所得气体的体积随时间变化如图所示,根据图中信息回答下列问题,(气体体积已换算成标准状况下的体积,且忽略气体在水中的溶解和溶液体积的变化)