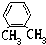题目内容
20.分别写出下列原电池的电极反应式和总反应式.
(1)负极Zn-2e-=Zn2+,正极2H++2e-=H2↑,总反应Zn+2H+=Zn2++H2↑;
(2)负极Zn-2e-=Zn2+,正极2H++2e-=H2↑,总反应Zn+2H+=Zn2++H2↑;
(3)负极Zn-2e-=Zn2+,正极Cu2++2e-=Cu,总反应Zn+Cu2+=Fe2++Cu;
(4)负极Fe+2H+=Fe2++H2↑,正极2H++2e-=H2↑,总反应Fe+2H+=Fe2++H2↑.
分析 原电池工作时,较为活泼的金属为负极,较不活泼的金属为正极,负极金属失电子被氧化,正极发生还原反应,题给电解质溶液中,正极可生成铜或氢气,以此解答该题.
解答 解:(1)负极是活泼金属Zn失电子发生氧化反应,电极反应式为:Zn-2e-=Zn2+,正极上是电解质溶液中的氢离子得电子发生还原反应,电极反应式为:2H++2e-=H2↑,总反应式为:Zn+2H+=Fe2++H2↑,故答案为:Zn-2e-=Zn2+;2H++2e-=H2↑;Zn+2H+=Zn2++H2↑;
(2)负极是活泼金属Zn失电子发生氧化反应,电极反应式为:Zn-2e-=Zn2+,正极上是电解质溶液中的氢离子得电子发生还原反应,电极反应式为:2H++2e-=H2↑,总反应式为:Zn+2H+=Fe2++H2↑,故答案为:Zn-2e-=Zn2+;2H++2e-=H2↑;Zn+2H+=Zn2++H2↑;
(3)负极是活泼金属Zn失电子发生氧化反应,电极反应式为:Zn-2e-=Zn2+,正极上是电解质溶液中的铜离子得电子发生还原反应,电极反应式为:Cu2++2e-=Cu,总反应式为:Zn+Cu2+=Fe2++Cu,故答案为:Zn-2e-=Zn2+;Cu2++2e-=Cu;Zn+Cu2+=Fe2++Cu;
(4)负极是活泼金属Fe失电子发生氧化反应,电极反应式为:Fe-2e-=Fe2+,正极上是电解质溶液中的氢离子得电子发生还原反应,电极反应式为:2H++2e-=H2↑,总反应式为:Fe+2H+=Fe2++H2↑,故答案为:Fe-2e-=Fe2+;2H++2e-=H2↑;Fe+2H+=Fe2++H2↑.
点评 本题考查了电极反应式书写和电池反应式书写,为高频考点,侧重于学生的分析能力的考查,注意把握原电池的工作原理,题目难度不大.

| 甲 | 乙 | 丙 | 丁 | |
| 化合物中各元素原子个数比 | A:C=1:1 | B:A=1:2 | D:E=1:3 | B:E=1:4 |
(1)甲的电子式
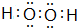 ,丁的结构式
,丁的结构式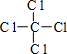
(2)E元素在周期表中的位置是第三周期ⅦA族,其最简单离子的结构示意图为
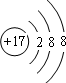 ,最高价氧化物的水化物化学式为HClO4.
,最高价氧化物的水化物化学式为HClO4.(3)五种元素中,既可以与盐酸反应,又可以与氢氧化钠溶液反应的是Al(填元素符号),并写出反应的离子方程式:2Al+6H+=2Al3++3H2↑、2Al+2OH-+2H2O=2AlO2-+3H2↑.
| A. |  | B. |  | C. |  | D. |  |
| A. | 分子组成中含碳氢原子个数比为1:2 | |
| B. | 能与溴发生加成反应而使溴水褪色,还能使酸性KMnO4溶液褪色 | |
| C. | 在空气中燃烧能产生黑烟 | |
| D. | 完全燃烧生成等物质的量的CO2和H2O |
| A. | H2S+2HNO3=S↓+2NO2↑+2H2O | B. | Cu+4HNO3(浓)=Cu(NO3)2+2NO2↑+2H2O | ||
| C. | CuO+2HNO3=Cu(NO3)2+H2O | D. | 4HNO3$\frac{\underline{\;\;△\;\;}}{\;}$4NO2↑+O2↑+2H2O |
| A. | 金属铯的熔点比金属钠高 | B. | CsOH比NaOH的碱性强 | ||
| C. | Cs与H2O能剧烈反应,但没有钠剧烈 | D. | 碳酸铯难溶于水 |
| A. | 碘和干冰的升华 | B. | 硅和冰的熔化 | ||
| C. | 氯化氢和氯化钾的溶解 | D. | 氯化钠和冰融化 |