题目内容
1.下列表述Ⅰ、表述Ⅱ均正确,且没有因果关系的是( )| 表述Ⅰ | 表述Ⅱ | |
| A | 在水中,NH3溶解度比I2的溶解度大 | NH3是极性分子,I2是非极性分子 |
| B | 通常条件下,HCl比HI稳定性高 | 非金属性:Cl>I |
| C | NH2OH中N的化合价为:-3 | 电负性:Cl>N |
| D | 沸点:SiO2>CO2 | 式量:SiO2>CO2 |
| A. | A | B. | B | C. | C | D. | D |
分析 A、氨气和水是极性分子,而碘是非极性分子,根据相似相溶;
B、元素非金属性越强氢化物越稳定;
C、NH2OH中N的化合价为:-1,元素非金属性越强电负性越大;
D、原子晶体的沸点高于分子晶体;式量二氧化硅大于二氧化碳,但两者的沸点与式量无关.
解答 解:A、氨气和水是极性分子,而碘是非极性分子,所以在水中,NH3溶解度比I2的溶解度大,表述Ⅰ、表述Ⅱ均正确,且有因果关系,故A错误;
B、非金属性:Cl>I,所以HCl比HI稳定性高,表述Ⅰ、表述Ⅱ均正确,且有因果关系,故B错误;
C、NH2OH中N的化合价为:-1,表述Ⅰ错误;元素非金属性越强电负性越大,两者无因果关系,故C错误;
D、原子晶体的沸点高于分子晶体;式量二氧化硅大于二氧化碳,但两者的沸点与式量无关,表述Ⅰ、表述Ⅱ均正确,且没有因果关系,故D符合;
故选D.
点评 本题元素化合物的性质与不同类型晶体的沸点的高低,题目难度中等,解答该题时注意找出反例,学习中注意把握元素周期律的递变规律.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
11.下列化学用语中,正确的是( )
| A. | 四氯化碳的电子式: | |
| B. | 镁的原子结构示意图为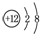 | |
| C. | 氯化氢分子的形成过程可用电子式表示为:H×+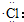 →H+[ →H+[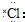 ]- ]- | |
| D. | 重水的化学式为${\;}_{1}^{2}$H2O(或D2O) |
12.下列各反应中属于加成反应的是( )
| A. | C2H4+3O2$\stackrel{点燃}{→}$2CO2+2H2O | |
| B. | H2+Cl2$\stackrel{光照}{→}$2HCl | |
| C. | CH2=CH2+Br2→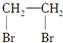 | |
| D. | CH3-CH3+2Cl2$\stackrel{催化剂}{→}$CH2Cl-CH2Cl+2HCl |
9.离子化合物①NaCl、②CaO、③NaF、④MgO中,晶格能从小到大顺序正确的是( )
| A. | ①②③④ | B. | ①③②④ | C. | ③①④② | D. | ④②①③ |
16.下列说法正确的是( )
| A. | 极性分子中一定没有非极性键 | B. | 非极性分子中一定不含极性键 | ||
| C. | 单质分子中一定存在非极性键 | D. | 极性分子中一定有极性键 |
10.如图是元素周期表的一部分,表中的①~⑩中元素,用元素符号或化学式填空回答:
(1)在这些元素中,化学性质最不活泼的原子的原子结构示意图为 ;
;
(2)地壳中含量最多的金属元素是Al,写出元素⑥③以原子个数比1:1形成化合物的电子式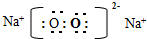 ;
;
(3)这些元素中的最高价氧化物对应的水化物中,酸性最强的是HClO4,碱性最强的是KOH;
(4)写出②⑦⑩对应离子还原性由强到弱的次序S2-Cl-F-.
 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 二 | ① | ⑥ | ② | |||||
| 三 | ③ | ⑤ | ④ | ⑩ | ⑦ | ⑧ | ||
| 四 | ⑨ |
 ;
;(2)地壳中含量最多的金属元素是Al,写出元素⑥③以原子个数比1:1形成化合物的电子式
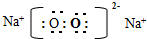 ;
;(3)这些元素中的最高价氧化物对应的水化物中,酸性最强的是HClO4,碱性最强的是KOH;
(4)写出②⑦⑩对应离子还原性由强到弱的次序S2-Cl-F-.
11.下列说法正确的是( )
| A. | 卫生部公告2011年5月1日起全面叫停面粉增白剂,由此可知:应当严格禁止在食品中使用任何食品添加剂 | |
| B. | BaSO4在医学上用作钡餐,Ba2+对人体无毒 | |
| C. | 往稀米粥中加入少量加碘食盐,能检验食盐中是否含碘 | |
| D. | 处理废水时加入明矾作为净水剂可以除去水中悬浮的杂质 |
 .
.