题目内容
16.下列说法正确的是( )| A. | 极性分子中一定没有非极性键 | B. | 非极性分子中一定不含极性键 | ||
| C. | 单质分子中一定存在非极性键 | D. | 极性分子中一定有极性键 |
分析 同种元素之间形成非极性共价键,不同元素之间形成极性共价键,分子中正负电荷中心不重合,从整个分子来看,电荷的分布是不均匀的,不对称的,这样的分子为极性分子,以极性键结合的双原子一定为极性分子,以极性键结合的多原子分子如结构对称,正负电荷的重心重合,电荷分布均匀,则为非极性分子.
解答 解:A.极性分子中可以有非极性键,如臭氧、过氧化氢中有非极性键,故A错误;
B.非极性分子中可以含极性键,如二氧化碳,故B错误;
C.单质分子中不一定纯在非极性键,如单原子分子,故C错误;
D.只有一个极性键的双原子分子一定是极性分子,故D正确.
故选D.
点评 本题考查了键的极性与分子极性的关系、化学键与元素之间的关系等知识点,为高频考点,侧重于基本概念的考查,注意相关知识的积累,把握共价键的分类及性质,难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
4.热化学方程式2H2(g)+O2(g)═2H2O(g)△H=-483.6 kJ•mol-1中,化学式前面的化学计量数表示( )
| A. | 分子数 | B. | 体积 | C. | 质量 | D. | 物质的量 |
11.酸根RO3-所含电子数比硝酸根NO3-的电子数多10,则下列说法正确的是( )
| A. | R原子的电子层数比N的电子层数多1 | |
| B. | RO3-中R的化合价与NO3-中的N的化合价不相等 | |
| C. | RO3-和NO3-只能被还原,不能被氧化 | |
| D. | R和N元素的原子含有相同数目的未成对电子 |
1.下列表述Ⅰ、表述Ⅱ均正确,且没有因果关系的是( )
| 表述Ⅰ | 表述Ⅱ | |
| A | 在水中,NH3溶解度比I2的溶解度大 | NH3是极性分子,I2是非极性分子 |
| B | 通常条件下,HCl比HI稳定性高 | 非金属性:Cl>I |
| C | NH2OH中N的化合价为:-3 | 电负性:Cl>N |
| D | 沸点:SiO2>CO2 | 式量:SiO2>CO2 |
| A. | A | B. | B | C. | C | D. | D |
5.下列各组中的性质比较,正确的是( )
| A. | 稳定性:NH3<PH3<SiH4 | B. | 酸性:HClO>H2SO3>H3PO4 | ||
| C. | 碱性:KOH>NaOH>Mg(OH)2 | D. | 还原性:F->Cl->Br->I- |
6.在下列反应中,水既不是氧化剂又不是还原剂的是( )
| A. | 2 Na+2 H2O═2 NaOH+H2↑ | B. | 3 NO2+H2O═2 HNO3+NO | ||
| C. | 2 F2+2 H2O═4 HF+O2↑ | D. | 2 H2O$\frac{\underline{\;电解\;}}{\;}$2 H2↑+O2↑ |

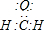 .
.