题目内容
11.下列化学用语中,正确的是( )| A. | 四氯化碳的电子式: | |
| B. | 镁的原子结构示意图为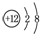 | |
| C. | 氯化氢分子的形成过程可用电子式表示为:H×+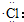 →H+[ →H+[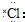 ]- ]- | |
| D. | 重水的化学式为${\;}_{1}^{2}$H2O(或D2O) |
分析 A.该电子式中漏掉了氯原子的3对孤电子对;
B.镁原子的核电荷数=核外电子总数=12,最外层含有2个电子;
C.;氯化氢为共价化合物,分子中不存在阴阳离子;
D.重水中的氢原子的中子数为1、质量数为2.
解答 解:A.四氯化碳为共价化合物,分子中氯原子、碳原子最外层都是8电子,四氯化碳正确的电子式为: ,故A错误;
,故A错误;
B.镁原子的最外层为2个电子,其正确的原子结构示意图为: ,故B错误;
,故B错误;
C.氯化氢属于共价化合物,分子中不存在阴阳离子,用电子式表示氯化氢的形成过程为: ,故C错误;
,故C错误;
D.重水分子中的氢原子为重氢原子,重氢的质量数为2,则重水的化学式为:${\;}_{1}^{2}$H2O(或D2O),故D正确;
故选D.
点评 本题考查了电子式、原子结构示意图、化学式等化学用语的判断,题目难度中等,注意掌握常见化学用语的概念及正确的表示方法,明确离子结构示意图与原子结构示意图、甲烷和四氯化碳的电子式的区别.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
19. 平衡原理探究题
平衡原理探究题
化学学科中存在着多种可逆过程和动态平衡,主要有化学平衡、电离平衡、水解平衡和沉淀溶解平衡等,且均遵循勒夏特列原理.请回答下列问题.
(1)一定温度下,在一个固定容积的密闭容器中,可逆反应
A(g)+2B(g)?4C(g)△H>0
达到平衡时,c(A)=2mol/L,c(B)=7mol/L,c(C)=4mol/L.试确定B的起始浓度c(B)的取值范围是[用c(B)、≤、≥、<、>、mol/L表示]3mol/L≤c(B)≤9mol/L,若改变条件重新达到平衡后体系中C的质量分数增大,下列措施可行的是C
A、增加C的物质的量 B、加压 C、升温 D、使用催化剂
(2)某学习小组探究盐样品K2CO3溶液显碱性的原因,取出少量向其中滴入2滴酚酞试液,溶液呈红色.甲同学认为是配制溶液所用样品中混有KOH,乙同学认为是盐水解.请你设计一个简单的实验方案给甲和乙两位同学的说法以评判,填空回答:
(3)常温下,取pH=2的盐酸和醋酸溶液各100mL,向其中分别加入适量的Zn粒,反应过程中两溶液的pH变化
如图所示.则图中表示醋酸溶液中pH变化曲线的是B(填“A”或“B”).设盐酸中加入的Zn质量
为m1,醋酸溶液中加入的Zn质量为m2.则m1<m2(选填“<”、“=”、“>”)
 平衡原理探究题
平衡原理探究题化学学科中存在着多种可逆过程和动态平衡,主要有化学平衡、电离平衡、水解平衡和沉淀溶解平衡等,且均遵循勒夏特列原理.请回答下列问题.
(1)一定温度下,在一个固定容积的密闭容器中,可逆反应
A(g)+2B(g)?4C(g)△H>0
达到平衡时,c(A)=2mol/L,c(B)=7mol/L,c(C)=4mol/L.试确定B的起始浓度c(B)的取值范围是[用c(B)、≤、≥、<、>、mol/L表示]3mol/L≤c(B)≤9mol/L,若改变条件重新达到平衡后体系中C的质量分数增大,下列措施可行的是C
A、增加C的物质的量 B、加压 C、升温 D、使用催化剂
(2)某学习小组探究盐样品K2CO3溶液显碱性的原因,取出少量向其中滴入2滴酚酞试液,溶液呈红色.甲同学认为是配制溶液所用样品中混有KOH,乙同学认为是盐水解.请你设计一个简单的实验方案给甲和乙两位同学的说法以评判,填空回答:
| 滴加试剂及量 | 所根据的现象 | 结论 |
| 是盐水解之故 |
如图所示.则图中表示醋酸溶液中pH变化曲线的是B(填“A”或“B”).设盐酸中加入的Zn质量
为m1,醋酸溶液中加入的Zn质量为m2.则m1<m2(选填“<”、“=”、“>”)
17.用NA表示阿伏加德罗常数,下列说法正确的是( )
| A. | 2.4 g 金属镁变成镁离子时失去的电子数为 0.2 NA | |
| B. | 标准状况下,18 g H2O中含有NA个水分子 | |
| C. | 常温常压下,11.2 L H2和O2的混合物所含分子个数是 0.5 NA | |
| D. | 1 mol/L NaOH溶液中含有的Na+数目是NA |
20.某反应过程能量变化如图所示,下列说法正确的是( )
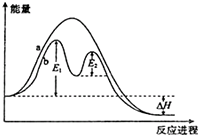

| A. | 反应过程a有催化剂参与 | |
| B. | 改变催化剂,可改变该反应的活化能 | |
| C. | 该反应为吸热反应,热效应等于△H | |
| D. | 加入催化剂,可以提升反应物的转化率 |
1.下列表述Ⅰ、表述Ⅱ均正确,且没有因果关系的是( )
| 表述Ⅰ | 表述Ⅱ | |
| A | 在水中,NH3溶解度比I2的溶解度大 | NH3是极性分子,I2是非极性分子 |
| B | 通常条件下,HCl比HI稳定性高 | 非金属性:Cl>I |
| C | NH2OH中N的化合价为:-3 | 电负性:Cl>N |
| D | 沸点:SiO2>CO2 | 式量:SiO2>CO2 |
| A. | A | B. | B | C. | C | D. | D |

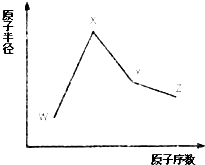 W、X、Y和Z是常见的短周期元素,其原子半径随原子序数变化如图所示.己知W的一种核素的质量数为18,中子数为10;X和Ne的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的原子半径在同周期主族元素中最小.
W、X、Y和Z是常见的短周期元素,其原子半径随原子序数变化如图所示.己知W的一种核素的质量数为18,中子数为10;X和Ne的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的原子半径在同周期主族元素中最小.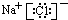 ;
;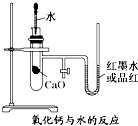 如图是某同学设计的放热反应的观察装置.
如图是某同学设计的放热反应的观察装置.