题目内容
9.离子化合物①NaCl、②CaO、③NaF、④MgO中,晶格能从小到大顺序正确的是( )| A. | ①②③④ | B. | ①③②④ | C. | ③①④② | D. | ④②①③ |
分析 这几种物质都是离子化合物,晶格能与离子半径成反比、与电荷成正比,据此分析解答.
解答 解:这几种物质都是离子晶体,离子晶体熔沸点与晶格能成正比,晶格能与离子半径成反比、与电荷成正比,镁离子、钙离子、氧离子电荷大于钠离子、氟离子和氯离子,钙离子的半径大于镁离子,而钠离子半径大于镁离子,氯离子半径大于氧离子和氟离子的半径,氧离子的半径大于氟离子的半径,所以晶格能从小到大顺序是①③②④,故选B.
点评 本题考查离子晶体晶格能比较,学生要知道晶格能大小影响因素,题目难度不大.

练习册系列答案
相关题目
17.用NA表示阿伏加德罗常数,下列说法正确的是( )
| A. | 2.4 g 金属镁变成镁离子时失去的电子数为 0.2 NA | |
| B. | 标准状况下,18 g H2O中含有NA个水分子 | |
| C. | 常温常压下,11.2 L H2和O2的混合物所含分子个数是 0.5 NA | |
| D. | 1 mol/L NaOH溶液中含有的Na+数目是NA |
20.某反应过程能量变化如图所示,下列说法正确的是( )
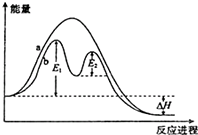

| A. | 反应过程a有催化剂参与 | |
| B. | 改变催化剂,可改变该反应的活化能 | |
| C. | 该反应为吸热反应,热效应等于△H | |
| D. | 加入催化剂,可以提升反应物的转化率 |
17.设NA为阿伏加德罗常数,下列有关叙述正确的是( )
| A. | 标准状况下,1L庚烷完全燃烧所生成的气态产物的分子数为($\frac{7}{22.4}$)NA | |
| B. | 1mol羟基(-OH)所含的电子总数为10NA | |
| C. | 硝化甘油、火棉、TNT都是硝酸酯 | |
| D. | 1mol碳正离子(CH3+)所含的电子总数为8NA |
4.热化学方程式2H2(g)+O2(g)═2H2O(g)△H=-483.6 kJ•mol-1中,化学式前面的化学计量数表示( )
| A. | 分子数 | B. | 体积 | C. | 质量 | D. | 物质的量 |
1.下列表述Ⅰ、表述Ⅱ均正确,且没有因果关系的是( )
| 表述Ⅰ | 表述Ⅱ | |
| A | 在水中,NH3溶解度比I2的溶解度大 | NH3是极性分子,I2是非极性分子 |
| B | 通常条件下,HCl比HI稳定性高 | 非金属性:Cl>I |
| C | NH2OH中N的化合价为:-3 | 电负性:Cl>N |
| D | 沸点:SiO2>CO2 | 式量:SiO2>CO2 |
| A. | A | B. | B | C. | C | D. | D |
18.下列物质的制备方法恰当的是( )
| A. | 往95%酒精中加入无水氯化钙,蒸馏得到无水乙醇 | |
| B. | 往2mL 10% CuSO4 溶液中滴加几滴2% NaOH,然后滴加少量乙醛,加热制得砖红色沉淀Cu2O | |
| C. | 用氯气和乙烷按1:1体积比混合,光照条件下,制纯一氯乙烷 | |
| D. | 往装有电石的烧瓶中逐滴滴加饱和食盐水,制粗乙炔 |
19.对于可逆反应,2SO2 (g)+O2(g)?2SO3(g)△H<0在一定温度下其平衡数为K,下列说法正确的是( )
| A. | 增大SO2的转化率K值一定增大 | B. | 减小压强K值减小 | ||
| C. | K值越大SO2转化率越大 | D. | 升高温度K值增大 |