题目内容
14.下列反应的离子方程式中,可以用H++OH-=H2O 表示的是( )| A. | 醋酸与KOH溶液 | B. | 氢氧化铜与盐酸 | ||
| C. | NaHSO4溶液与氨水 | D. | 硝酸与Ba(OH)2溶液 |
分析 离子方程式可以用H++OH-=H2O表示,说明酸碱都是可溶性强电解质且酸碱中和时不能生成其它的气体、沉淀、弱电解质等物质,据此分析解答.
解答 解:离子方程式可以用H++OH-=H2O表示,说明酸碱都是可溶性强电解质且酸碱中和时不能生成其它的气体、沉淀、弱电解质等物质,
A.醋酸是弱电解质,应该写化学式不能写离子,故A错误;
B.氢氧化铜难溶于水,应该写化学式不能写离子,故B错误;
C.一水合氨是弱电解质,应该写化学式不能写离子,故C错误;
D.硝酸和氢氧化钡都是可溶性强电解质且二者中和时不生成其它气体、沉淀、弱电解质等物质,所以可以用H++OH-=H2O表示其离子方程式,故D正确;
故选D.
点评 本题考查离子方程式的书写,明确离子方程式书写规则即电解质强弱、溶解性即可解答,气体、沉淀、弱电解质、单质、氧化物等都写化学式,题目难度不大.

练习册系列答案
相关题目
4.银锌电池广泛用作电子仪器的电源,它的充电和放电过程可表示为:
Ag2O+Zn+H2O$?_{充电}^{放电}$2Ag+Zn(OH)2.此电池放电时负极反应的生成物是( )
Ag2O+Zn+H2O$?_{充电}^{放电}$2Ag+Zn(OH)2.此电池放电时负极反应的生成物是( )
| A. | Ag | B. | Zn(OH)2 | C. | Ag2O | D. | Zn |
5.下列物质能促进水的电离,且溶液显酸性的是( )
| A. | NH4Cl | B. | NaF | C. | KOH | D. | H2SO4 |
2.纽扣电池的两极材料为锌和氧化银,电解质溶液为KOH溶液.放电时两个电极反应分别为:Zn+2OH-→Zn(OH)2+2e-Ag2O+H2O+2e-→2Ag+2OH- 下列说法中正确的是( )
| A. | 锌是正极,氧化银是负极 | |
| B. | 锌发生还原反应,氧化银发生氧化反应 | |
| C. | 溶液中OH-向正极移动,K+、H+向负极移动 | |
| D. | 在电池放电的过程中,电解质溶液的碱性变大 |
19.下列反应的离子方程式正确的是( )
| A. | 氯气通入氢氧化钠溶液中 Cl2+2OH-=Cl-+ClO-+H2O | |
| B. | 金属铁与稀硝酸反应 Fe+2H+=Fe2++H2↑ | |
| C. | 在硅酸钠溶液中滴加稀硫酸 SiO32-+2H+=H2SO3↓ | |
| D. | 铜粉与98.3%的硫酸加热下反应 Cu+4H++SO42-=Cu2++SO2↑+2H2O |
3.某同学想用实验证明高锰酸钾溶液的紫红色是MnO4-离子的颜色,而不是K+离子的颜色,他设计的下列实验步骤中没有意义的是( )
| A. | 将高锰酸钾晶体加热分解,所得固体质量减少 | |
| B. | 观察氯化钾溶液没有颜色,表明溶液中K+无色 | |
| C. | 在氯化钾溶液中加入适量锌粉振荡,静置后未见明显变化,表明锌与K+无反应 | |
| D. | 在高锰酸钾溶液中加入适量锌粉振荡,静置后见紫红色褪去,表明MnO4-离子为紫红色 |
4.下列说法正确的是( )
| A. | pH均为9的①Na2CO3溶液、②CH3COONa溶液、③NaOH溶液,其物质的量浓度的大小顺序为①>②>③ | |
| B. | 等物质的量浓度的Na2CO3溶液和NaHCO3溶液等体积混合,所得溶液中:c(CO32-)+c(OH-)<c(H+)+c(HCO3-)+3c(H2CO3) | |
| C. | 0.1 mol•L-1KHC2O4溶液中:c(OH-)=c(H+)+c(H2C2O4)-2c(C2O42-) | |
| D. | pH=3的二元弱酸H2R溶液与pH=11的NaOH溶液混合后,混合液的pH等于7,则反应后的混合液:c(R2-)+c(HR-)=c(Na+) |
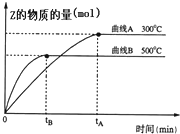 向a L密闭容器中加入1mol X气体和2mol Y气体,发生如下反应:X(g)+2Y(g)?2Z(g),不同温度下,测得平衡状态Z的物质的量变化曲线如图所示.
向a L密闭容器中加入1mol X气体和2mol Y气体,发生如下反应:X(g)+2Y(g)?2Z(g),不同温度下,测得平衡状态Z的物质的量变化曲线如图所示.