题目内容
4.下列说法正确的是( )| A. | pH均为9的①Na2CO3溶液、②CH3COONa溶液、③NaOH溶液,其物质的量浓度的大小顺序为①>②>③ | |
| B. | 等物质的量浓度的Na2CO3溶液和NaHCO3溶液等体积混合,所得溶液中:c(CO32-)+c(OH-)<c(H+)+c(HCO3-)+3c(H2CO3) | |
| C. | 0.1 mol•L-1KHC2O4溶液中:c(OH-)=c(H+)+c(H2C2O4)-2c(C2O42-) | |
| D. | pH=3的二元弱酸H2R溶液与pH=11的NaOH溶液混合后,混合液的pH等于7,则反应后的混合液:c(R2-)+c(HR-)=c(Na+) |
分析 A.先判断浓度相等时三种溶液的pH大小,再判断当溶液的pH相等时,该溶液的物质的量浓度大小;
B.混合液显示碱性,c(OH-)>c(H+),结合物料守恒和电荷守恒进行判断;
C.根据KHC2O4溶液中的电荷守恒和物料守恒判断;
D.混合液的pH=7,则c(OH-)=c(H+),结合电荷守恒分析.
解答 解:A.①Na2CO3溶液 ②CH3COONa溶液 ③NaOH溶液,物质的量浓度相等时,氢氧化钠属于碱类,其pH最大,醋酸钠和碳酸钠水解显示碱性,醋酸根的水解程度小于碳酸根的水解程度,所以碳酸钠的碱性强于醋酸钠的碱性,即③>①>②,则pH相等时三种溶液的浓度大小为:②>①>③,故A错误;
B.等浓度等体积的Na2CO3、NaHCO3溶液中,则碳酸钠和碳酸氢钠的浓度相等,根据电荷守恒可得:①c(CO32-)+2c(OH-)+c(HCO3-)=c(H+)+c(Na+),根据物料守恒可得:②2c(Na+)=3c(CO32-)+3c(H2CO3+3c(HCO3-),根据①②可得:c(CO32-)+2c(OH-)=c(HCO3-)+3c(H2CO3)+2c(H+),由于混合液显示碱性,则c(OH-)>c(H+),故c(CO32-)+c(OH-)<c(H+)+c(HCO3-)+3c(H2CO3),故B正确;
C.0.1 mol•L-1KHC2O4溶液中,根据电荷守恒可得:2c(C2O42-)+c(OH-)+c(HC2O4-)=c(H+)+c(K+),根据物料守恒可得:c(C2O42-)+c(H2C2O4)+c(HC2O4-)=c(K+),二者结合可得:c(OH-)=c(H+)+c(H2C2O4)-c(C2O42-),故C错误;
D.pH=3的二元弱酸H2R溶液与pH=11的NaOH溶液混合后,混合液的pH等于7,则c(OH-)=c(H+),根据电荷守恒可得:2c(R2-)+c(HR-)=c(Na+),故D错误;
故选B.
点评 本题考查了离子浓度大小比较,题目难度中等,涉及盐的水解原理、酸碱混合的定性判断、溶液pH的计算、离子浓度大小比较等知识,试题知识点较多,充分考查学生的分析、理解能力及灵活应用基础知识的能力,注意掌握电荷守恒、物料守恒及盐的水解原理在判断离子浓度大小中的应用方法.

| A. | 醋酸与KOH溶液 | B. | 氢氧化铜与盐酸 | ||
| C. | NaHSO4溶液与氨水 | D. | 硝酸与Ba(OH)2溶液 |
| A. | 氧化还原反应均为放热反应 | B. | 放热反应中,反应后体系能量降低 | ||
| C. | 断开化学键的过程会放出能量 | D. | 加热才能发生的反应均为吸热反应 |
| 粒子 | A+ | B2- | C | D | E | F |
| 组成特点 | 单核离子 | 化合物, 双核分子 | 单质, 双核分子 | 化合物, 三核分子 | 化合物, 四核分子 | |
(1)A的元素符号是K,B2-的结构示意图是
 .
.(2)C与D混合,发生反应的化学方程式为F2+2HCl═2HF+Cl2.
(3)E的电子式是
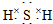 ;F的水溶液常用于消毒剂,F的化学式是H2O2.
;F的水溶液常用于消毒剂,F的化学式是H2O2. 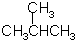 的名称是( )
的名称是( )| A. | 2-甲基丁烷 | B. | 2-甲基丙烷 | C. | 1,1-二甲基乙烷 | D. | 三甲基甲烷 |
| A. | 将工厂的烟囱造高,可提高燃煤的燃烧效率,并可减少工厂周围的大气污染 | |
| B. | 垃圾焚烧法已成为许多城市垃圾处理的主要方法之一,利用垃圾焚烧产生的热能发电或供热,能较充分地利用生活垃圾中的生物质能 | |
| C. | 珍惜地球资源,发展低碳经济,积极开发使用风能、太阳能等新能源,可减少二氧化碳等气体的排放量 | |
| D. | 回收处理废旧电池既可节约金属资源又可减少环境污染,应积极开发废电池的综合利用技术 |
| A. | pH=13的NaOH溶液中含有H+的浓度为0.l mol/L | |
| B. | 向NaHCO3溶液中加入少量NaOH固体,可抑制HCO3-的水解,使c(HCO3-)增大 | |
| C. | 将任意量的CH3COOH溶液与NaOH溶液混合,其混合溶液均存在: C(Na+)+c(H+)=c(CH3COO-)+c(OH-) | |
| D. | Na2CO3溶液中:c(Na+)>c(CO32-)>c(OH-)=c(HCO3-)>c(H+) |

 .
. .
. .
.