题目内容
6.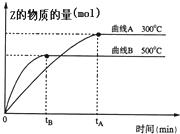 向a L密闭容器中加入1mol X气体和2mol Y气体,发生如下反应:X(g)+2Y(g)?2Z(g),不同温度下,测得平衡状态Z的物质的量变化曲线如图所示.
向a L密闭容器中加入1mol X气体和2mol Y气体,发生如下反应:X(g)+2Y(g)?2Z(g),不同温度下,测得平衡状态Z的物质的量变化曲线如图所示.(1)曲线A和曲线B哪条代表的反应速率快?B
(2)在一定温度下,此反应达到平衡的标志是ABCD
A、单位时间消耗0.1mol X,同时生成0.2mol Y
B、容器内Y的浓度不随时间变化
C、容器内Z的体积分数不随时间变化
D、容器内气体的压强不随时间变化
(3)反应达到平衡时,平衡常数表达式K=$\frac{{c}^{2}(Z)}{c(X).{c}^{2}(Y)}$,升高温度,K值减小(填“增大”、“减小”或“不变”).
分析 (1)反应速率越快,反应达到平衡的时间越短;
(2)可逆反应达到平衡状态时,正逆反应速率相等,反应体系中各物质的物质的量不变、物质的量浓度不变、百分含量不变以及由此引起的一系列物理量不变;
(3)K=$\frac{{c}^{2}(Z)}{c(X).{c}^{2}(Y)}$;根据图知,升高温度,Z的物质的量减小,说明平衡逆向移动,则反应物浓度增大、生成物浓度减小.
解答 解:(1)反应速率越快,反应达到平衡的时间越短,根据图知,B曲线达到平衡的时间段,所以反应速率快,故答案为:B;
(2)可逆反应达到平衡状态时,正逆反应速率相等,反应体系中各物质的物质的量不变、物质的量浓度不变、百分含量不变以及由此引起的一系列物理量不变,
A、单位时间消耗0.1mol X、同时生成0.2mol Y,同时生成0.1molX,正逆反应速率相等,则达到平衡状态,故A正确;
B、容器内Y的浓度不随时间变化,说明正逆反应速率相等,则反应达到平衡状态,故B正确;
C、容器内Z的体积分数不随时间变化,说明正逆反应速率相等,则反应达到平衡状态,故C正确;
D、该反应前后气体计量数之和减小,则容器内气体的压强不随时间变化时,正逆反应速率相等,该反应达到平衡状态,故D正确;
故选ABCD;
(3)K=$\frac{{c}^{2}(Z)}{c(X).{c}^{2}(Y)}$;根据图知,升高温度,Z的物质的量减小,说明平衡逆向移动,则反应物浓度增大、生成物浓度减小,则K值减小,故答案为:$\frac{{c}^{2}(Z)}{c(X).{c}^{2}(Y)}$;减小.
点评 本题考查图象分析,涉及化学平衡常数判断、化学平衡状态判断等知识点,明确图中纵横坐标含义是解本题关键,难点是平衡状态判断,只有反应前后改变的物理量才能作为判断依据,题目难度不大.

 华东师大版一课一练系列答案
华东师大版一课一练系列答案| A. | 阳极发生氧化反应,其电极反应式主要是:Ni-2e-=Ni2+ | |
| B. | 电解过程中,阳极质量的减少与阴极质量的增加不相等 | |
| C. | 电解后,溶液中存在的金属阳离子只有Fe2+、Ni2+和Zn2+ | |
| D. | 电解后,电解槽底部的阳极泥中只有Pt |
| A. | 醋酸与KOH溶液 | B. | 氢氧化铜与盐酸 | ||
| C. | NaHSO4溶液与氨水 | D. | 硝酸与Ba(OH)2溶液 |
| A. | HCHO溶液、(NH4)2SO4溶液均能使蛋白质变性 | |
| B. | 分子式为C2H4O2的有机物不一定是羧酸 | |
| C. | 煤的干馏是物理变化,煤的气化和液化是化学变化 | |
| D. | 纤维素、蛋白质、油脂、糖类在一定条件下都能发生水解反应 |

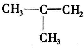 、CH3CH=CHCH3和CH3CH2CH=CH2.
、CH3CH=CHCH3和CH3CH2CH=CH2.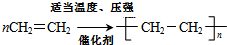 ,其产物的名称是聚乙烯;乙烯对水果具有催熟功能.
,其产物的名称是聚乙烯;乙烯对水果具有催熟功能.
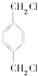 .
.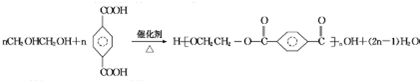 .
.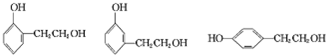 .
.