题目内容
14.氯气、氨气等物质在生产和科研中都有重要应用.(1)若发生大量氯气泄漏事故,下列措施中正确的是ab.
a.立即通报相关部门,迅速撤离事故现场
b.用蘸有肥皂水的毛巾捂住口鼻立即逆风疏散
c.用蘸有NaOH溶液的毛巾捂住口鼻立即顺风疏散
(2)事故发生后,可用NaOH稀溶液处理泄漏的氯气,反应的离子方程式是Cl2+2OH-=Cl-+ClO-+H2O.
(3)实验室用氨气还原氧化铜的方法,通过测定反应物CuO和生成物H2O的质量[m(CuO)、m(H2O)],测定铜的近似相对原子质量.反应的化学方程式是:2NH3+3CuO$\frac{\underline{\;\;△\;\;}}{\;}$N2+3Cu+3H2O.备选仪器装置如下.

①用上述装置制氨气时,能否将碳酸盐换成氯化铵?否(回答“是”或“否”),用化学方程式说明理由.HCl+NH3=NH4Cl.
②仪器从左到右的连接顺序(用字母编号表示,仪器可重复使用)是BDADC.C中的试剂是浓硫酸,其作用是防止空气中的水和CO2进入D装置,吸收多余的氨气.
③铜的相对原子质量是$\frac{18m(CuO)}{m({H}_{2}O)}$-16[用含有m(CuO)、m(H2O)的式子表示].
分析 (1)a氯气泄露应通知关部门,迅速撤离事故现场;
b根据氯气能和碱、水反应,逆风减少氯气的吸入量;
c烧碱具有强烈的腐蚀性;
(2)氯气与氢氧化钠反应生成氯化钠、次氯酸钠和水;
(3)①根据氯化铵易分解和氯化氢与氨气易反应生成氯化铵分析;
②按照气体发生装置、除杂装置、性质检验装置、尾气处理装置等顺序组装仪器;
③根据方程式结合M=$\frac{m}{M}$进行计算
解答 解:(1)a氯气泄露应通知关部门,迅速撤离事故现场,故a选;
b氯气能和碱、水反应,逆风减少氯气的吸入量,故b选;
c烧碱具有强烈的腐蚀性,能够腐蚀皮肤,故c不选;
故选:ab;
(2)氯气和氢氧化钠溶液反应生成氯化钠、次氯酸钠和水,反应的离子方程式为Cl2+2OH-=Cl-+ClO-+H2O,
故答案为:Cl2+2OH-=Cl-+ClO-+H2O;
(3)①制备氨气时应用碳酸铵和氢氧化钙反应,而不能用氯化铵,因氯化铵分解生成的氨气和氯化氢气体易反应而重新生成氯化铵,反应的方程式为HCl+NH3=NH4Cl,
故答案为:否;HCl+NH3=NH4Cl;
②氨气还原氧化铜时,应先制备氨气,并用碱石灰干燥氨气,生成的氨气在加热条件下与氧化铜反应,生成的水用碱石灰吸收以测定生成水的质量,最后用浓硫酸吸收氨气并防止空气中的水和CO2进入D装置以免造成误差,
故答案为:BDADC;浓硫酸;防止空气中的水和CO2进入D装置,吸收多余的氨气;
③根据反应的方程式计算
2NH3+3CuO$\frac{\underline{\;\;△\;\;}}{\;}$N2+3Cu+3H2O
3mol 3mol
$\frac{m(CuO)}{M(Cu)+16}$ $\frac{m({H}_{2}O)}{18}$
M(CuO)=$\frac{18m(CuO)}{m({H}_{2}O)}$-16;
故答案为:$\frac{18m(CuO)}{m({H}_{2}O)}$-16;
点评 本题考查了氨气的制备和性质的检验,熟悉制备原理是解题关键,题目难度不大.

| A. | 若5.6LN2中含有n个氮分子,则阿伏加德罗常数一定为4n | |
| B. | 4.6gNa与100 mL含0.1mol HCl的盐酸溶液反应,转移电子数目为0.2NA | |
| C. | 14g乙烯和丙烯的混合气体中所含分子总数为0.5NA | |
| D. | 标准状况下,22.4LCCl4含有的分子总数为NA |
| A. | 在周期表中过渡元素可作为催化剂 | |
| B. | 化学键可以使离子结合,也可以使原子结合 | |
| C. | 常温常压下,相同体积的O2和O3具有相同的分子数 | |
| D. | F2、Cl2、Br2、I2共价键逐渐增强,熔点依次升高 |
| A. | n=m+1 | B. | n=m+10 | C. | n=m+11 | D. | n=m+25 |
| A. | 标准状况下,2.24LC6H14中含有1.9NA个共用电子对 | |
| B. | 7.8gNa2O2固体中含阴离子数目为0.1NA | |
| C. | 含36.5gHCl的浓盐酸与足量的二氧化锰作用,能产生0.25NA个氯气分子 | |
| D. | 5.6gFe与足量的氯气反应转移的电子数目为0.2NA |
| A. | 使 pH 试纸呈红色的溶液:Fe2+、NH4+、Cl-、NO3- | |
| B. | pH=13的溶液:S2-、SO32-、SO42-、Na+ | |
| C. | 使红色石蕊试纸变蓝色的溶液:K+、HCO3-、Br-、Ba2+ | |
| D. | 含有溶质为K2SO4的溶液:AlO2-、Na+、Al3+、Ba2+ |
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 零 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
(2)在最高价氧化物的水化物中,酸性最强的化合物的分子式是HClO4(填元素符号).
(3)元素②的气态氢化物分子属于非电解质(填电解质或非电解质);元素⑦与④形成化合物的电子式是
 .
.(4)元素⑤的最高价氧化物与氢氧化钠溶液反应的离子方程式为:Al2O3+2OH-=H2O+2AlO2-.
(5)元素④的某氧化物可作供氧剂,该氧化物中所含的化学键类型有离子键、共价键,写出其与二氧化碳反应的化学方程式2Na2O2+2CO2=2Na2CO3+O2.
| A. | 1molC2H6O中含有C-C键的数目一定为NA | |
| B. | 25℃,pH=12的NaHCO3溶液中含有OH-的数目为0.01NA | |
| C. | 标准状况下,2.24L异丁烷含有的分子数目为0.1NA | |
| D. | 常温常压下,0.3molNO2与足量H2O充分反应,转移电子的数目为0.3NA |
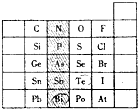 元素在周期表中的位置,反映了元素的原子结构和元素的性质.右图是元素周期表的一部分.
元素在周期表中的位置,反映了元素的原子结构和元素的性质.右图是元素周期表的一部分.