题目内容
下列电离方程式中正确的是( )
| A、H2SO4=H2++SO42- |
| B、NaHCO3=Na++H++CO32- |
| C、Ca(OH)2=Ca2++2OH- |
| D、CaCl2=Ca+2+2Cl- |
考点:电离方程式的书写
专题:电离平衡与溶液的pH专题
分析:A.氢离子是带1个单位正电荷;
B.碳酸氢根离子是弱酸的酸根离子是一个整体不能拆;
C.氢氧化钙为强电解质,根据电离方程式的书写规则进行分析;
D.根据离子符号的正确书写进行分析.
B.碳酸氢根离子是弱酸的酸根离子是一个整体不能拆;
C.氢氧化钙为强电解质,根据电离方程式的书写规则进行分析;
D.根据离子符号的正确书写进行分析.
解答:
解:A.氢离子是带1个单位正电荷,物质电离后角标要转化成化学计量数,正确的离子方程式为:H2SO4=2H++SO42-,故A错误;
B.碳酸氢钠电离时生成钠离子和碳酸氢根离子,碳酸氢根离子是弱酸的酸根离子是一个整体不能拆,电离方程式为NaHCO3═Na++HCO3-,故B错误;
C.氢氧化钙为强电解质,完全电离,该离子方程式离子书写正确,电荷守恒,故C正确;
D.离子符号书写时数字写在正负号的前面,正确的离子方程式为:CaCl2=Ca2++2Cl-,故D错误;
故选C.
B.碳酸氢钠电离时生成钠离子和碳酸氢根离子,碳酸氢根离子是弱酸的酸根离子是一个整体不能拆,电离方程式为NaHCO3═Na++HCO3-,故B错误;
C.氢氧化钙为强电解质,完全电离,该离子方程式离子书写正确,电荷守恒,故C正确;
D.离子符号书写时数字写在正负号的前面,正确的离子方程式为:CaCl2=Ca2++2Cl-,故D错误;
故选C.
点评:本题考查电离方程式的书写,解答本题的关键是要熟悉元素的离子的标法,所有阳离子所带电荷总数,必须等于所有阴离子所带电荷总数,强电解质用“═”,注意遵循电荷守恒、质量守恒定律来书写电离方程式,注意原子团不可拆分,题目难度不大.

练习册系列答案
相关题目
下列说法或解释不正确的是( )
| A、等物质的量浓度的下列溶液中,①NH4Al(SO4)2②NH4Cl③CH3COONH4④NH3?H2O,c(NH4+)由大到小的顺序是:②>①>④>③ |
| B、室温下,向0.01mol?L-1NH4HSO4溶液中滴加NaOH溶液至中性:c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+) |
| C、向0.2mol?L-1NaHCO3溶液中加如等体积0.1mol?L-1NaOH溶液:c(CO32-)>c(HCO3-)>c(OH-)>c(H+) |
| D、对于反应N2H4(l)=N2(g)+2H2(g)△H=-50.6kJ?mol-1在任何温度下都能自发进行 |
根据以下实验事实,判断四种微粒在酸性条件下,氧化性由强到弱的顺序是( )
①向FeCl3溶液中滴加KI溶液,再加入CCl4振荡,CCl4层呈紫色;
②向FeCl2溶液中加入氯水,再加入KSCN溶液,呈红色;
③向KMnO4溶液中加入浓盐酸,振荡后紫色褪去.
①向FeCl3溶液中滴加KI溶液,再加入CCl4振荡,CCl4层呈紫色;
②向FeCl2溶液中加入氯水,再加入KSCN溶液,呈红色;
③向KMnO4溶液中加入浓盐酸,振荡后紫色褪去.
| A、I2>Cl2>Fe3+>MnO4- |
| B、MnO4->Cl2>Fe3+>I2 |
| C、Cl2>I2>Fe3+>MnO4- |
| D、Fe3+>MnO4->Cl2>I2 |
设NA为阿伏加德罗常数,下列说法正确的是( )
| A、若C2H6分子中含共价键数为7NA,则乙烷的体积为22.4L |
| B、58.5g氯化钠固体中含NaCl分子数为NA |
| C、78g液态笨分子中含碳碳双键数目为3NA |
| D、28g N2和6g H2在高温高压铁触媒催化作用下,生成的NH3分子数一定小于2NA |
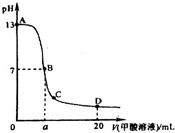 甲酸为一元弱酸,在15mL 0.1mol/L KOH溶液中逐滴加入0.2mol/L甲酸溶液,溶液的pH变化和所加入的甲酸的体积关系描绘成如图所示曲线.下面有关微粒浓度的大小关系正确的是( )
甲酸为一元弱酸,在15mL 0.1mol/L KOH溶液中逐滴加入0.2mol/L甲酸溶液,溶液的pH变化和所加入的甲酸的体积关系描绘成如图所示曲线.下面有关微粒浓度的大小关系正确的是( )| A、在A、B间的任意一点上都存在:c(K+)>c(HCOO-)>c(OH-)>c(H+) |
| B、在B点:c(K+)=c(HCOO-)>c(OH-)=c(H+),且a=7.5 |
| C、在C点:c(HCOO-)>c(K+)>(H+)>c(OH-) |
| D、在D点:c(HCOO-)+c(HCOOH)=2c(K+) |
下列反应的离子方程式正确的是( )
| A、氢氧化铜和盐酸反应:OH-+H+═H2O |
| B、钠和水反应:Na+2H2O═Na++2OH-+H2↑ |
| C、铁和足量稀硝酸反应:Fe+2H+═Fe2++H2↑ |
| D、常温下,NaOH溶液和Cl2反应:2OH-+Cl2═Cl-+ClO-+H2O |
新型高效多功能水处理剂Na2FeO4的制备方法可用化学方程式表示为:
2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑
对此反应下列说法不正确的是( )
2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2↑
对此反应下列说法不正确的是( )
| A、在反应中Na2FeO4只是氧化产物 | ||
B、在反应中有
| ||
| C、2mol FeSO4发生反应时,共有10mol电子转移 | ||
| D、此反应氧化剂为Na2O2 |
下列关于糖类、油脂、蛋白质的说法正确的是( )
| A、糖类物质一定能发生水解反应 |
| B、油脂可用于制造肥皂等 |
| C、糖类、油脂、蛋白质的组成元素均为C、H、O |
| D、蛋白质遇饱和硫酸钠溶液会凝聚,失去生理功能 |
下列指定溶液中,各组离子可能大量共存的是( )
| A、pH=1的溶液中:K+、Fe2+、Cl-、NO3- |
| B、在强酸溶液中:Na+、ClO-、Cl-、Ba2+ |
| C、在含有大量Fe3+的溶液中:NH4+、Cl-、Na+、SCN- |
| D、由水电离的c(H+)=10-13mol?L-1的溶液中:Mg2+、Cl-、K+、SO42- |