题目内容
下列说法或解释不正确的是( )
| A、等物质的量浓度的下列溶液中,①NH4Al(SO4)2②NH4Cl③CH3COONH4④NH3?H2O,c(NH4+)由大到小的顺序是:②>①>④>③ |
| B、室温下,向0.01mol?L-1NH4HSO4溶液中滴加NaOH溶液至中性:c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+) |
| C、向0.2mol?L-1NaHCO3溶液中加如等体积0.1mol?L-1NaOH溶液:c(CO32-)>c(HCO3-)>c(OH-)>c(H+) |
| D、对于反应N2H4(l)=N2(g)+2H2(g)△H=-50.6kJ?mol-1在任何温度下都能自发进行 |
考点:离子浓度大小的比较
专题:盐类的水解专题
分析:A.①铝离子水解抑制铵根离子的水解;②铵根离子水解;③醋酸根离子水解促进铵根离子水解;④弱碱电离,且电离的程度很弱;
B.反应后溶液显示中性,则c(OH-)=c(H+),当硫酸氢铵与氢氧化钠按照1:1反应时,反应生成硫酸铵,溶液显示酸性,如果显示中性,则氢氧化钠应该过量,所以c(Na+)>c(SO42-),根据电荷守恒可知,c(Na+)+c(NH4+)=2c(SO42-),所以c(NH4+)<(SO42-);
C.向0.2mol?L-1NaHCO3溶液中加如等体积0.1mol?L-1NaOH溶液,反应后的溶质为等浓度的碳酸氢钠和碳酸钠,碳酸根离子的水解沉淀大于碳酸氢根离子的水解沉淀,则c(CO32-)<c(HCO3-);
D.根据△G=△H-T?△S进行判断,如△G<0,则反应能自发进行,如△G>0,则不能自发进行.
B.反应后溶液显示中性,则c(OH-)=c(H+),当硫酸氢铵与氢氧化钠按照1:1反应时,反应生成硫酸铵,溶液显示酸性,如果显示中性,则氢氧化钠应该过量,所以c(Na+)>c(SO42-),根据电荷守恒可知,c(Na+)+c(NH4+)=2c(SO42-),所以c(NH4+)<(SO42-);
C.向0.2mol?L-1NaHCO3溶液中加如等体积0.1mol?L-1NaOH溶液,反应后的溶质为等浓度的碳酸氢钠和碳酸钠,碳酸根离子的水解沉淀大于碳酸氢根离子的水解沉淀,则c(CO32-)<c(HCO3-);
D.根据△G=△H-T?△S进行判断,如△G<0,则反应能自发进行,如△G>0,则不能自发进行.
解答:
解:A.同浓度的下列溶液,①NH4Al(SO4)2②NH4Cl③CH3COONH4④NH3?H2O,因①中铝离子水解抑制铵根离子的水解;②中铵根离子水解;③醋酸根离子水解促进铵根离子水解,④为弱碱的电离,且电离的程度很弱;则c(NH4+)由大到小的顺序是:①>②>③>④,故A错误;
B.向0.01mol/L NH4HSO4溶液中滴加NaOH溶液至中性,若1:1反应,溶液显酸性,则NaOH应该过量,则c(Na+)>c(SO42-),显中性时溶液的溶质为硫酸钠,硫酸铵、一水合氨,c(Na+)+c(NH4+)=2c(SO42-),由于c(Na+)>c(SO42-),则c(NH4+)<(SO42-),溶液中离子浓度大小为:c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+),故B正确;
C.两溶液混合后反应生成等浓度的碳酸钠和碳酸氢钠,由于碳酸根离子的水解程度比碳酸氢根离子的水解程度大,所以溶液中c(CO32-)<c(HCO3-),溶液中各离子浓度大小为:c(HCO3-)>c(CO32-)>c(OH-)>c(H+),故C错误;
D.反应N2H4(l)=N2(g)+2H2(g)△H=-50.6kJ?mol-1中,△H<0、△S>0,则△G=△H-T?△S<0,反应在任何温度下都能自发进行,故D正确;
故选AC.
B.向0.01mol/L NH4HSO4溶液中滴加NaOH溶液至中性,若1:1反应,溶液显酸性,则NaOH应该过量,则c(Na+)>c(SO42-),显中性时溶液的溶质为硫酸钠,硫酸铵、一水合氨,c(Na+)+c(NH4+)=2c(SO42-),由于c(Na+)>c(SO42-),则c(NH4+)<(SO42-),溶液中离子浓度大小为:c(Na+)>c(SO42-)>c(NH4+)>c(OH-)=c(H+),故B正确;
C.两溶液混合后反应生成等浓度的碳酸钠和碳酸氢钠,由于碳酸根离子的水解程度比碳酸氢根离子的水解程度大,所以溶液中c(CO32-)<c(HCO3-),溶液中各离子浓度大小为:c(HCO3-)>c(CO32-)>c(OH-)>c(H+),故C错误;
D.反应N2H4(l)=N2(g)+2H2(g)△H=-50.6kJ?mol-1中,△H<0、△S>0,则△G=△H-T?△S<0,反应在任何温度下都能自发进行,故D正确;
故选AC.
点评:本题考查了离子浓度大小比较、反应能否自发进行的判断,题目难度中等,注意掌握盐的水解原理及其影响,明确判断反应能否自发进行的方法,能够根据盐的水解原理、电荷守恒、物料守恒、质子守恒判断溶液中各离子浓度大小.

练习册系列答案
相关题目
下列各项操作中,不发生“先产生沉淀,然后沉淀又溶解”现象的是( )
①向饱和碳酸钠溶液中通入过量的CO2 ②向Fe(OH)3胶体中逐滴加入过量的稀盐酸
③向NaAlO2溶液中通入过量的CO2 ④向澄清石灰水中通入缓慢过量的CO2.
①向饱和碳酸钠溶液中通入过量的CO2 ②向Fe(OH)3胶体中逐滴加入过量的稀盐酸
③向NaAlO2溶液中通入过量的CO2 ④向澄清石灰水中通入缓慢过量的CO2.
| A、①② | B、①④ | C、①③ | D、②③ |
观察如图几个装置示意图,有关叙述正确的是( )
A、装置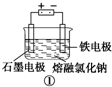 工业上可用于生产金属钠,电解过程中石墨电极产生金属,此法也可用于生产活泼金属镁、铝等 工业上可用于生产金属钠,电解过程中石墨电极产生金属,此法也可用于生产活泼金属镁、铝等 |
B、装置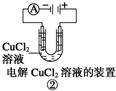 中随着电解的进行左边电极会产生红色的铜,并且电流表示数不断变小 中随着电解的进行左边电极会产生红色的铜,并且电流表示数不断变小 |
C、装置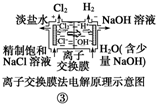 中的离子交换膜只允许阳离子、阴离子和小分子水通过 中的离子交换膜只允许阳离子、阴离子和小分子水通过 |
D、装置 的待镀铁制品应与电源正极相连 的待镀铁制品应与电源正极相连 |
下列有关物质的分类或归类正确的是( )
①混合物:冰醋酸、水玻璃、水银 ②化合物:CaCl2、烧碱、聚乙烯
③电解质:明矾、胆矾、硫酸钡 ④同素异形体:C60、金刚石、石墨
⑤同位素:1H、2H、3H.
①混合物:冰醋酸、水玻璃、水银 ②化合物:CaCl2、烧碱、聚乙烯
③电解质:明矾、胆矾、硫酸钡 ④同素异形体:C60、金刚石、石墨
⑤同位素:1H、2H、3H.
| A、①③④ | B、③④⑤ |
| C、②③④ | D、②④⑤ |
下列电离方程式中正确的是( )
| A、H2SO4=H2++SO42- |
| B、NaHCO3=Na++H++CO32- |
| C、Ca(OH)2=Ca2++2OH- |
| D、CaCl2=Ca+2+2Cl- |
 某校高三同学高考前重做以下两个课本实验,请你回答实验过程中的相关问题:
某校高三同学高考前重做以下两个课本实验,请你回答实验过程中的相关问题: 如图所示的装置,在盛有水的烧杯中,等质量的铁圈和银圈的连接在一起,吊着一根绝缘的细丝,使之平衡.小心地从烧杯中央滴入CuSO4溶液.试回答下列问题:(相对原子质量:Fe-56,Cu-64)
如图所示的装置,在盛有水的烧杯中,等质量的铁圈和银圈的连接在一起,吊着一根绝缘的细丝,使之平衡.小心地从烧杯中央滴入CuSO4溶液.试回答下列问题:(相对原子质量:Fe-56,Cu-64)