题目内容
【题目】.甲胺铅碘(CH3NH3PbI3)可用作全固态钙钛矿敏化太阳能电池的敏化剂,该物质可由甲胺(CH3NH2)、PbI2 及 HI 为原料来合成。请回答下列问题:
(1)制取甲胺的反应为 CH3OH(g)+NH3(g)==CH3NH2(g)+H2O(g),已知该反应中相关化学键的键能数据如下表所示:
共价键 | C-O | H-O | N-H | C-N |
键能/(kJ | 351 | 463 | 393 | 293 |
则该反应的△H=_____kJ·mol-1
(2)工业上利用水煤气合成甲醇的反应为 CO(g)+2H2(g) ![]() CH3OH(g) △H<0。一定温度下, 向体积为 2L 的密闭容器中加入 CO 和 H2,5min 末反应达到化学平衡状态,测得各组分浓度如下表所示。
CH3OH(g) △H<0。一定温度下, 向体积为 2L 的密闭容器中加入 CO 和 H2,5min 末反应达到化学平衡状态,测得各组分浓度如下表所示。
物质 | CO | H2 | CH3OH |
浓度/(mol | 0.9 | 1.0 | 0.6 |
①0~5min 内,用 CO 表示的平均反应速率为_____。
②既能加快反应速率,又能提高氢气转化率的措施有_____(答一条即可)。
③能说明上述反应已达化学平衡状态的是_____(填字母)。
A.v正 (CO)=2v逆 (H2)
B.混合气体密度保持不变
C.反应容器内压强保持不变
D.混合气体的平均摩尔质量不变
(3)PbI2 可由 Pb3O4 和 HI 反应制备,反应的化学方程式为_____。
(4)常温下 PbI2 饱和溶液中 c(I-)=2.0×10-3mol·L-1,则 Ksp(PbI2)=________;已知Ksp(PbS)=4.0×10-28,则反应 PbI2(s)+2-(aq) ![]() PbS(s)+2I-(aq)的平衡常数K=_______________________。
PbS(s)+2I-(aq)的平衡常数K=_______________________。
(5)HI 的分解反应曲线和液相法制备 HI 的反应曲线分别如图 1 和图 2 所示:
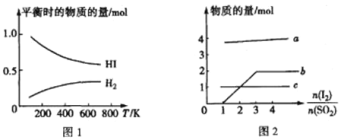
①反应 H2(g)+I2(g)![]() 2HI(g)的△H__________(填“>”或“<")0。
2HI(g)的△H__________(填“>”或“<")0。
②将 SO2 通入碘水中会发生反应:SO2+I2+2H2O==4H++SO42-+2I-,I2+I- ![]() I3-。图 2 中曲线 b 所代表的微粒是_____(填微粒符号)。
I3-。图 2 中曲线 b 所代表的微粒是_____(填微粒符号)。
【答案】-12 0.12molL-1·min-1 加压(或增大 CO 的浓度) CD Pb3O4+8HI=3PbI2+I2+4H2O 4.0×10-9 1.0×1019 < I3-
【解析】
(1)根据△H=反应物的键能之和-生成物的键能之和进行计算;
(2)根据速率公式进行计算,根据影响化学平衡的移动因素及化学平衡标志进行分析
(3)根据得失电子守恒、质量守恒配平可得反应的化学方程式;
(4)根据沉淀溶解平衡常数进行分析;
(5)根据影响化学平衡的移动因素进行分析。
(1)CH3OH(g)+NH3(g)=CH3NH2(g)+H2O(g) △H=反应物的键能之和-生成物的键能之和=(351+393-463-293)kJ/mol=-12 kJ/mol;
答案为-12。
(2)①CO(g)+2H2(g) ![]() CH3OH(g),速率之比等于化学计量数之比,所以v(CH3OH)=v(CO)=
CH3OH(g),速率之比等于化学计量数之比,所以v(CH3OH)=v(CO)=![]() =0.12mol/(L min);
=0.12mol/(L min);
答案为 0.12mol/(L min);
②提高氢气转化率要使平衡右移,既能加快反应速率,又能提高氢气转化率的措施有加压(或增大 CO 的浓度),故答案为加压或增大 CO 的浓度。
③A.如果是 2v正(CO)=v逆(H2),可以说明反应达到平衡状态,故A不符合题意;
B.反应前后气体的总质量不变,气体总体积不变,气体的密度始终不变,不能根据密度判断平衡状态,故B不符合题意;
C.反应前后气体分子数目不等,故反应容器内压强保持不变,可以说明反应达到平衡状态,故C符合题意;
D. 混合气体的平均摩尔质量= ![]() ,总质量是一定的,反应前后气体分子数目不等,气体总物质的量如果不变,混合气体的平均摩尔质量就不变,所以混合气体的平均摩尔质量不变可以说明反应达到平衡状态,故 D 符合题意;
,总质量是一定的,反应前后气体分子数目不等,气体总物质的量如果不变,混合气体的平均摩尔质量就不变,所以混合气体的平均摩尔质量不变可以说明反应达到平衡状态,故 D 符合题意;
故选CD。
(3)PbI2 可由 Pb3O4 和 HI 反应制备,同时生成 I2,Pb 元素化合价从![]() 价变为+2 价,I 元素化合价从-1 价变为 0 价,根据得失电子守恒、质量守恒配平可得反应的化学方程式为Pb3O4+8HI=3PbI2+I2+4H2O;
价变为+2 价,I 元素化合价从-1 价变为 0 价,根据得失电子守恒、质量守恒配平可得反应的化学方程式为Pb3O4+8HI=3PbI2+I2+4H2O;
故答案为 Pb3O4+8HI=3PbI2+I2+4H2O;
(4)Ksp(PbI2)=c(Pb2+) c2(I-)=1.0×10-3× (2.0×10-3)2=4.0×10-9,反应 PbI2(s)+S2-(aq)![]() PbS(s)+2I-(aq)的平衡常数 K=
PbS(s)+2I-(aq)的平衡常数 K= ![]() =
=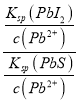 =
=![]() =1.0×1019;
=1.0×1019;
故答案为 4.0×10-9;1.0×1019;
(5)①升温,HI 的物质的量减少,即平衡左移,所以正反应为放热反应,△H<0;
故答案为<。
②根据 SO2+I2+2H2O===4H++SO42-+2I-,I2+I-![]() I3-得,随着
I3-得,随着 ![]() 的增大,n(H+)和 n(SO42-)保持不变,而 n(I-)增大,所以 b 所代表的微粒是 I-;
的增大,n(H+)和 n(SO42-)保持不变,而 n(I-)增大,所以 b 所代表的微粒是 I-;
故答案为 I3-。

【题目】已知:pAg=-lgc(Ag+),pX=-lg c(Xn-)。298K时,几种物质的Ksp如下表:
化学式 | AgCl | AgSCN | Ag2CrO4 |
颜色 | 白 | 浅黄 | 红 |
Ksp | 1.8×1010 | 1.0×1012 | 2.0×1012 |
AgCl、AgSCN、Ag2CrO4的饱和溶液中,阳离子和阴离子的浓度关系如图所示。下列说法正确的是
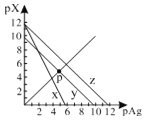
A.图中x代表AgCl曲线,z代表AgSCN曲线
B.298K时,在Cl-和CrO42-的物质的量浓度均为0.1mol/L的溶液中,滴入少量0.1mol/L的AgNO3溶液,首先产生的是红色沉淀
C.298K时若增大p点的阴离子浓度,则y上的点沿曲线向上移动
D.298K时Ag2CrO4(s)+2SCN-(aq) ![]() 2AgSCN(s)+CrO42- (aq)的平衡常数K=2.0×1012
2AgSCN(s)+CrO42- (aq)的平衡常数K=2.0×1012