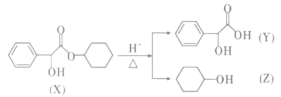
题目内容
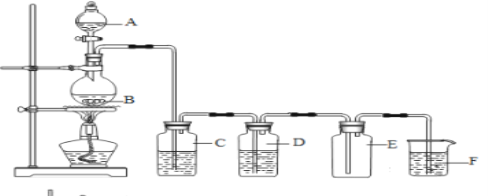
【题目】下图是一个实验室制取氯气并以氯气为原料进行特定反应的装置(B中有导管和一个连通外界的长颈漏斗):

(1)A是氯气发生装置,其中反应的化学方程式为__________________________.
(2)实验开始时,先点燃A处的酒精灯,打开旋塞K,让Cl2充满整个装置,再点燃D处酒精灯,Cl2通过C瓶后再进入D。D装置的硬质玻璃管内盛有炭粉,发生氧化还原反应,其产物为CO2和HCl。试写出D中反应的化学方程式:___________________;装置C的作用是_________________ 。
(3)在E处,紫色石蕊试液的颜色由紫色变为红色,再变为无色,其原因是__。
(4)若将E处烧杯中溶液改为澄清石灰水,反应过程中现象为___。(选填标号)
(A)有白色沉淀生成(B)无明显变化(C)先生成白色沉淀,而后白色沉淀消失
(5)D处反应完毕后,关闭旋塞K,移去酒精灯,但由于余热的作用,A处仍有Cl2产生,此时B中的现象是__,B的作用是___________________________________。
【答案】(1)4HCl + MnO2![]() MnCl2+2H2O+Cl2↑
MnCl2+2H2O+Cl2↑
(2)2Cl2+2H2O(g)+C![]() 4HCl↑+CO2↑
4HCl↑+CO2↑
吸收Cl2中的HCl气体,提供D处所需水蒸气。
(3)生成的HCl气体使紫色石蕊溶液变红,因未反应完的Cl2与H2O作用产生的HClO的漂白作用使红色消失。
(4)B
(5)瓶中液面下降,长颈漏斗内液面上升;贮存少量Cl2
【解析】

【题目】(1)基态Fe2+的核外电子排布式为_______________,基态Ti3+的未成对电子有_____个。
(2)1mol[Ni(CO)4]2+ 中,配离子中含有σ键数目为________________
(3)有机物 HCHO的VSEPR构型为_______________。(填名称)
(4)抗坏血酸的分子结构如图所示,该分子中碳原子的轨道杂化类型为_________、____________
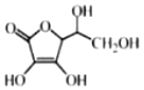
(5)向硫酸铜溶液中逐滴加入氨水先产生沉淀,后沉淀溶解为深蓝色溶液,请根据实验现象写出有关反应的离子方程式______________; ________。
(6)已知:下列物质断开1mol共价键吸收的能量或形成1mol共价键释放的能量数据如表:
共价键 | H﹣H | N﹣H | N≡N |
能量变化/kJmol﹣1 | 436 | 390.8 | 946 |
则合成氨反应:N2(g)+3H2 (g)=2NH3(g)△H=_________kJmol﹣1