题目内容
【题目】最近科学家获得了一种稳定性好、抗氧化能力强的活性化合物A;其结构如下:
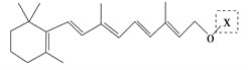
为了研究X的结构,将化合物A在一定条件下水解只得到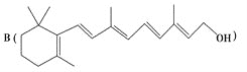 和C。经元素分析及相对分子质量测定,确定C的分子式为C7H6O3,C遇FeCl3水溶液显紫色,与NaHCO3溶液反应有CO2产生。
和C。经元素分析及相对分子质量测定,确定C的分子式为C7H6O3,C遇FeCl3水溶液显紫色,与NaHCO3溶液反应有CO2产生。
请回答下列问题:
(1)化合物B能发生下列哪些类型的反应________。
A.取代反应 B.加成反应
C.缩聚反应 D.氧化反应
(2)写出化合物C所有可能的结构简式______________________________。
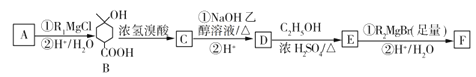
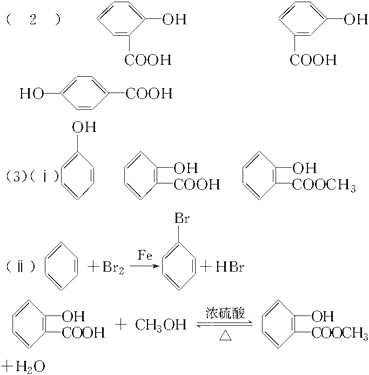
(3)C可通过下图所示途径合成,并制取冬青油和阿司匹林。

(ⅰ)写出有机物的结构简式:D:______________,C:________________,E:______________。
(ⅱ)写出变化过程中①、⑥的化学方程式(注明反应条件)
反应①__________________________________;反应⑥_____________________________。
(ⅲ)变化过程中的②属于____________反应,⑦属于________反应。
【答案】(1)A、B、D
(ⅲ)水解(取代) 酯化(取代)
【解析】
(1)B分子中有醇羟基可发生取代反应、氧化反应;分子中有碳碳双键,可发生加成反应;故选ABD。(2)C的分子式为C7H6O3,遇FeCl3水溶液显紫色,则有酚羟基;与NaHCO3溶液反应有CO2产生,则有—COOH;故C可能的结构简式为: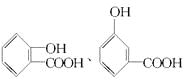 、
、![]() 。(3)解答该题可以按照合成流程图进行顺推和逆推,判断出各物质的种类和结构简式,然后写出相应的化学方程式。由C与CH3COOH反应生成了阿司匹林可逆推C为
。(3)解答该题可以按照合成流程图进行顺推和逆推,判断出各物质的种类和结构简式,然后写出相应的化学方程式。由C与CH3COOH反应生成了阿司匹林可逆推C为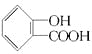 ,由此可顺推E为
,由此可顺推E为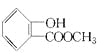 。
。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目