题目内容
【题目】已知:pAg=-lgc(Ag+),pX=-lg c(Xn-)。298K时,几种物质的Ksp如下表:
化学式 | AgCl | AgSCN | Ag2CrO4 |
颜色 | 白 | 浅黄 | 红 |
Ksp | 1.8×1010 | 1.0×1012 | 2.0×1012 |
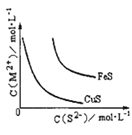
AgCl、AgSCN、Ag2CrO4的饱和溶液中,阳离子和阴离子的浓度关系如图所示。下列说法正确的是
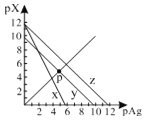
A.图中x代表AgCl曲线,z代表AgSCN曲线
B.298K时,在Cl-和CrO42-的物质的量浓度均为0.1mol/L的溶液中,滴入少量0.1mol/L的AgNO3溶液,首先产生的是红色沉淀
C.298K时若增大p点的阴离子浓度,则y上的点沿曲线向上移动
D.298K时Ag2CrO4(s)+2SCN-(aq) ![]() 2AgSCN(s)+CrO42- (aq)的平衡常数K=2.0×1012
2AgSCN(s)+CrO42- (aq)的平衡常数K=2.0×1012
【答案】D
【解析】
A、根据图中曲线x的数据知pAg=-lgc(Ag+)=6,c(Ag+)=10-6mol/L,pX=-lg c(Xn-)=0,则c(Cl-)=1mol/L,Ksp(AgCl)= 10-6,与表中数据不符,选项A错误;
B、析出沉淀时,AgCl溶液中c(Ag+)= =
=![]() mol/L,Ag2CrO4溶液中c(Ag+)=
mol/L,Ag2CrO4溶液中c(Ag+)=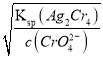 =
=![]() mol/L,c(Ag+)越小,先生成沉淀,则首先产生白色沉淀,选项B错误;
mol/L,c(Ag+)越小,先生成沉淀,则首先产生白色沉淀,选项B错误;
C、298K时若增大p点的阴离子浓度,由图可知,若沿曲线向上移动,c(Ag+)减小,选项C错误;
D、298K时Ag2CrO4(s)+2SCN-(aq) ![]() 2AgSCN(s)+CrO42- (aq)的平衡常数K=
2AgSCN(s)+CrO42- (aq)的平衡常数K=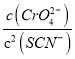 =
=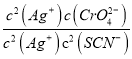 =
=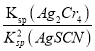 =
=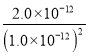 =2.0×1012,选项D正确。
=2.0×1012,选项D正确。
答案选D。

【题目】Ⅰ.金属冶炼与处理中常涉及离子反应和氧化还原反应。
(1)实验室常用无水乙醇处理少量残留的金属钠,写出反应的化学方程式_________。
(2)镁与碳在加强热时可生成易水解的MgC2,其水解的化学方程式为________。
(3)我国古代劳动人民曾利用明矾溶液除去铜器表面的铜锈[Cu2(OH)2CO3],请简要解释其原理:_______。
Ⅱ.(4)0.1 mol·L-1NaHCO3溶液与0.1 mol·L-1NaOH溶液等体积混合,所得溶液中离子浓度由大到小的顺序是:______________。
(5)恒温恒容条件下,在密闭容器中通入等物质的量的CO2和H2,发生反应CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g)。下列描述能说明该反应达到平衡状态的是_____(填序号)。
CH3OH(g)+H2O(g)。下列描述能说明该反应达到平衡状态的是_____(填序号)。
A 容器内的混合气体的平均相对分子质量保持不变
B 水分子中断裂2NA个H-O键,同时氢分子中生成3NA个H-H键
C CH3OH和H2O的浓度保持不变
D 容器内的混合气体的密度保持不变
(6)现有反应CH3OCH3(g)+H2O(g) ![]() 2CH3OH(g) △H=+23.4 kJ/mol,在某温度下的平衡常数为0.25,此温度下,在密闭容器中加入等物质的量的CH3OCH3(g)和H2O(g),反应到10min时测得各组分浓度如下:
2CH3OH(g) △H=+23.4 kJ/mol,在某温度下的平衡常数为0.25,此温度下,在密闭容器中加入等物质的量的CH3OCH3(g)和H2O(g),反应到10min时测得各组分浓度如下:
物质 | CH3OCH3(g) | H2O(g) | CH3OH(g) |
浓度/mol·L-1 | 0.9 | 0.9 | 1.2 |
此时v正_______v逆(填“>”、“<”或“=”),v (CH3OH) =_______;当反应达到平衡状态时,混合气体中CH3OCH3体积分数(CH3OCH3)%=______%。