题目内容
【题目】能量是人类生存基础,因此化学反应与能量关系一直是研究热点,贯穿于生活和生产各个领域 .
(1)在25℃、101kPa下,16g的甲醇(CH3OH)完全燃烧生成CO2和液态水时放出352kJ的热量,则表示甲醇燃烧热的热化学方程式为_______
(2)化学反应中放出的热能(焓变),△H与反应物和生成物的键能E有关。
已知:H2(g)+Cl2(g)=2HCl(g) △H=-185kJ/mol, E(H-H)=436kJ/mol,E(Cl-Cl)=243kJ/mol。
则E(H-Cl)=___________
(3)纳米级Cu2O由于具有优良的催化性能而受到关注,已知:
2Cu(s)+![]() O2(g)=CuO(s) △H=-169kJ.mol-1.
O2(g)=CuO(s) △H=-169kJ.mol-1.
C(s)+![]() O2(g)=CO(g) △H=-110.5kJ.mol-1
O2(g)=CO(g) △H=-110.5kJ.mol-1
2Cu(s)+O2(g)=2CuO(s) △H=-314kJ.mol-1
则工业上用炭粉在高温条件下还原CuO制取Cu和CO的热化学方程__________
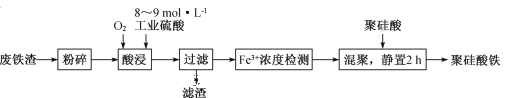
(4)如图是N2和H2反应生成2molNH3过程中能量变化示意图
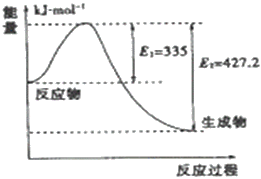
①请计算每生成1moNH3放出热量为___________
②若起始时向容器内放入1moN2和3molH2达平衡后N2的反应体积分数为20%,则反应放出的热量为Q1kJ,则Q1的数值为___________
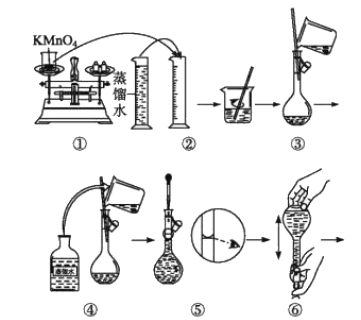
(5)炭黑是雾霾中的重要颗粒物,研究发现它可以活化氧分子,生成活化氧,活化过程的能量变化模拟计算结果如图所示,活化氧可以快速氧化二氧化硫。下列说法错误的是_______
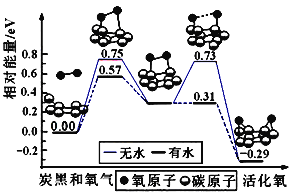
A.氧分子的活化包括O-O键的断裂与C-O键的生成
B.每活化一个氧分子放出0.29eV的能量
C.水可使氧分子活化反应的活化能降低0.42eV
D.炭黑颗粒是大气中二氧化硫转化为三氧化硫的催化剂
【答案】CH3OH(l)+![]() O2(g)═CO2(g)+2H2O (l) △H=-704kJ/mol 432kJ/mol C(s)+2CuO(s)=Cu2O(s)+CO(g)△H=+34.5kJmol-1 46.1kJ 18.44 C
O2(g)═CO2(g)+2H2O (l) △H=-704kJ/mol 432kJ/mol C(s)+2CuO(s)=Cu2O(s)+CO(g)△H=+34.5kJmol-1 46.1kJ 18.44 C
【解析】
依据燃烧热概念是1mol可燃物完全燃烧生成稳定氧化物放出的热量书写热化学方程式,标注物质聚集状态和对应焓变写出;依据反应的焓变△H=反应物键能总和-生成物键能总和计算;依据热化学方程式和盖斯定律计算得到所需热化学方程式;分析图象N2和H2反应生成2mol NH3过程中能量变化示意图计算每生成1mol NH3放出的热量。
(1)16g的甲醇(CH3OH)完全燃烧生成CO2和液态水时放出352kJ的热量,32g甲醇即1mol,燃烧生成二氧化碳和液态水放热704kJ,标注物质聚集状态和对应焓变写出热化学方程式为:CH3OH(l)+![]() O2(g)═CO2(g)+2H2O (l) △H=-704kJ/mol;故答案为: CH3OH(l)+
O2(g)═CO2(g)+2H2O (l) △H=-704kJ/mol;故答案为: CH3OH(l)+![]() O2(g)═CO2(g)+2H2O (l) △H=-704kJ/mol;
O2(g)═CO2(g)+2H2O (l) △H=-704kJ/mol;
(2)H2(g)+Cl2(g)═2HCl(g)△H=-185kJ/mol;E(H-H)=436kJ/mol,E(Cl-Cl)=243kJ/mol
△H=反应物键能总和-生成物键能总和得到:-185kJ/mol=436KJ/mol+243KJ/mol-2E(H-Cl)
则E(H-Cl)=432kJ/mol;故答案为:432kJ/mol;
(3)已知:①2Cu(s)+![]() O2(g)=CuO(s) △H=-169kJ.mol-1
O2(g)=CuO(s) △H=-169kJ.mol-1
②C(s)+![]() O2(g)=CO(g) △H=-110.5kJ.mol-1
O2(g)=CO(g) △H=-110.5kJ.mol-1
③2Cu(s)+O2(g)=2CuO(s) △H=-314kJ.mol-1
用炭粉在高温条件下还原CuO制取Cu2O和CO的化学方程式为C(s)+2CuO(s)=Cu2O(s)+CO(g),该反应可以是②-③-![]() ×①,反应的焓变是-110.5kJmol-1-(-314kJmol-1)-
×①,反应的焓变是-110.5kJmol-1-(-314kJmol-1)-![]() ×(-169kJmol-1)=+34.5kJmol-1,
×(-169kJmol-1)=+34.5kJmol-1,
故答案为:C(s)+2CuO(s)=Cu2O(s)+CO(g)△H=+34.5kJmol-1。
(4)①图象分析可知,N2和H2反应生成2mol NH3过程中能量变化示意图可知反应放热427.2KJ-335KJ=92.2kJ,每生成1mol NH3放出热量46.1kJ;故答案为:46.1kJ;
②如图是N2和H2反应生成2mol NH3过程中能量变化示意图,反应焓变△H=335kJ/mol-427.2kJ/mol=-92.2kJ/mol,
N2(g)+3H2(g)=2NH3(g)△H=-92.2kJ/mol
1 3 0
0.2 0.6 0.4
生成0.4mol氨气放热=![]() ×92.2KJ=18.44kJ;故答案为:18.44;
×92.2KJ=18.44kJ;故答案为:18.44;
(5)A、根据图象分析,氧分子活化过程O-O键断裂,生成C-O键,所以氧分子的活化是O-O的断裂与C-O键的生成过程,故A正确;
B、由图可知,反应物的总能量高于生成物的总能量,因此每活化一个氧分子放出0.29eV的能量,故B正确;
C、化能反应过程中存在多步反应的活化能,整个反应的活为活化能较大者,根据能量图分析,整个反应的活化能为活化能较大者,则没有水加入的反应活化能为E=0.75eV,有水加入的反应的活化能为E=0.57eV,所以水可使氧分子活化反应的活化能降低0.75eV-0.57eV=0.18eV,故C错误;
D、活化氧可以快速氧化二氧化硫,而炭黑颗粒可以活化氧分子,因此炭黑颗粒可以看作大气中二氧化硫转化为三氧化硫的催化剂,故D正确;
答案为C。

【题目】下表中离子方程式及其评价均合理的是( )
选项 | 化学反应及离子方程式 | 评价 |
A | 氧化亚铁溶于稀硝酸FeO+2H+=Fe2++H2O | 碱性氧化物与酸反应生成盐和水,正确 |
B | 向亚硫酸铵溶液中加少量氢氧化钡溶液Ba2++SO | 复分解反应,有沉淀生成,正确 |
C | 含nmolFeBr2的溶液中通入nmolCl2完全反应:2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl- | 氧化还原反应离子方程式满足元素守恒、电子守恒、电荷守恒,正确 |
D | 氯化铁溶液中滴入硫氰化钾溶液:Fe3++3SCN-=Fe(SCN)3 | 复分解反应,无气体生成,无沉淀生成,不正确 |
A.AB.BC.CD.D