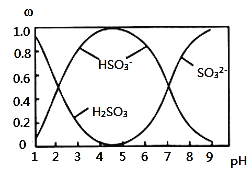
题目内容
【题目】人体血液里Ca2+的浓度一般采用mgcm-3来表示。抽取一定体积的血样,加适量的草酸铵[(NH4)2C2O4]溶液,可析出草酸钙(CaC2O4)沉淀,将此草酸钙沉淀洗涤后溶于强酸可得草酸(H2C2O4),再用KMnO4溶液滴定即可测定血液样品中Ca2+的浓度。某研究性学习小组设计如下实验步骤测定血液样品中Ca2+的浓度。
[配制KMnO4标准溶液]如图是配制100mLKMnO4标准溶液的过程示意图。
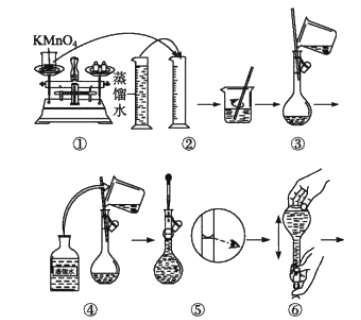
(1)根据图示判断,其中不正确的操作有___(填序号)。
(2)其中确定100mL溶液体积的容器是___(填名称)。
(3)如果忘记洗涤烧杯,所配制的溶液浓度将___;如果定容时仰视,所配制的溶液浓度将___(填“偏大”或“偏小”)。
[测定血液样品中Ca2+的浓度]抽取血样40.00mL,经过上述处理后得到草酸,再用0.020molL-1KMnO4溶液滴定,使草酸转化成CO2逸出,这时共消耗24.00mLKMnO4溶液。
(4)请书写草酸与KMnO4溶液反应的离子方程式:___。
(5)经过计算,血液样品中Ca2+的浓度为___mgcm-3。
【答案】②⑤ 100mL容量瓶 偏小 偏小 2MnO![]() +5H2C2O4+6H+=2Mn2++l0CO2↑+8H2O 1.2
+5H2C2O4+6H+=2Mn2++l0CO2↑+8H2O 1.2
【解析】
根据配制一定物质的量浓度的基本操作分析判断,误差分析紧扣c=![]() 判断即可,根据得失电子守恒、原子守恒和电荷守恒书写离子方程式,用关系式法计算。
判断即可,根据得失电子守恒、原子守恒和电荷守恒书写离子方程式,用关系式法计算。
(1)量筒只能量取溶液,不能稀释或溶解药品;定容时,视线要与凹液面最低处相切,所以错误为②⑤;
(2)配制100mL溶液需要100mL容量瓶,所以确定100mL溶液体积的仪器是100mL容量瓶,故答案为:100 mL容量瓶;
(3)根据c=![]() 判断误差,若忘记洗涤烧杯,容量瓶内溶质物质的量偏小,则所配制的溶液浓度将偏小;如果定容时仰视,溶液体积偏大,所配制的溶液浓度将偏小;
判断误差,若忘记洗涤烧杯,容量瓶内溶质物质的量偏小,则所配制的溶液浓度将偏小;如果定容时仰视,溶液体积偏大,所配制的溶液浓度将偏小;
(4)草酸具有还原性,高锰酸钾具有强氧化性,二者发生氧化还原反应生成锰离子、二氧化碳和水,根据得失电子守恒、原子守恒和电荷守恒,反应的离子方程式为2MnO4-+5H2C2O4+6H+═2 Mn2++10CO2↑+8H2O;
(5)关系式为5Ca2+~5C2O42-~2MnO4-,设钙离子的质量为xg,已知滴定消耗24.00mL0.020molL-1KMnO4溶液,其物质的量为0.020molL-1×0.024L=4.8×10-4mol,则![]() =4.8×10-4mol×
=4.8×10-4mol×![]() ,解得:x=0.048,钙离子浓度=
,解得:x=0.048,钙离子浓度=![]() =1.2 mgcm-3。
=1.2 mgcm-3。

 快乐5加2金卷系列答案
快乐5加2金卷系列答案