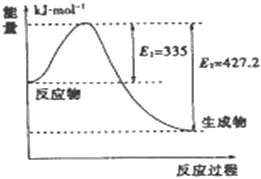
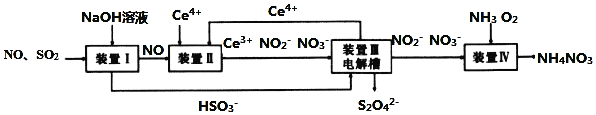
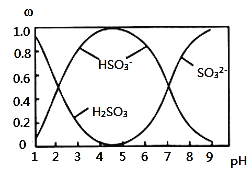
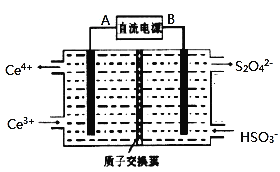
题目内容
【题目】工业上以铬铁矿![]() 主要成份为
主要成份为![]() ,还含有
,还含有![]() 、
、![]() 等杂质
等杂质![]() 为主要原料生产红矾钠晶体
为主要原料生产红矾钠晶体![]() ,其主要工艺流程如图:
,其主要工艺流程如图:
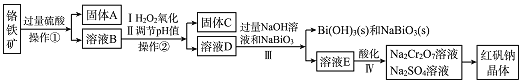
已知:![]() 在碱性条件下能将
在碱性条件下能将![]() 氧化为
氧化为![]() 。
。
![]() 固体A为 ______。
固体A为 ______。
![]() 实验室中操作
实验室中操作![]() 的名称为_____________。
的名称为_____________。
![]() 固体C中含有的物质是
固体C中含有的物质是![]()
![]() 和
和![]() ,则
,则![]() 的作用是 ______ 。
的作用是 ______ 。
已知:![]() ,
,![]() ,当
,当![]() 时
时![]() 开始沉淀.室温下,Ⅱ中需调节溶液pH范围为 ___
开始沉淀.室温下,Ⅱ中需调节溶液pH范围为 ___ ![]() 杂质离子浓度小于
杂质离子浓度小于![]() 视为沉淀完全
视为沉淀完全![]() 。
。
![]()
![]() Ⅳ中酸化是用硫酸而不用盐酸酸化,理由是 ______
Ⅳ中酸化是用硫酸而不用盐酸酸化,理由是 ______ ![]() 结合化学方程式回答
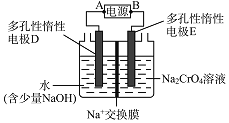
结合化学方程式回答![]() ;工业上也可设计如图示装置,用锂离子电池
;工业上也可设计如图示装置,用锂离子电池![]() 为难电离锂碳化合物
为难电离锂碳化合物![]() 为电源,电解
为电源,电解![]() 溶液制取
溶液制取![]() ,该装置工作时E电极的名称是 ___ 极;电源的A极的电极反应式为 ______
,该装置工作时E电极的名称是 ___ 极;电源的A极的电极反应式为 ______ ![]() 当电解过程中转移了
当电解过程中转移了![]() 电子时,理论上右侧溶液的质量减少 ______g。
电子时,理论上右侧溶液的质量减少 ______g。
【答案】![]() 过滤 氧化
过滤 氧化![]() ,使铁元素完全转化成沉淀而除去
,使铁元素完全转化成沉淀而除去 ![]()
![]()
![]() 阳
阳 ![]()
![]() 。
。
【解析】
铬铁矿![]() 主要成分为FeO和
主要成分为FeO和![]() ,含有
,含有![]() 、
、![]() 等杂质
等杂质![]() ,加入过量稀硫酸,只有
,加入过量稀硫酸,只有![]() 与稀硫酸不反应,则过滤得固体A为
与稀硫酸不反应,则过滤得固体A为![]() ,溶液B中含有
,溶液B中含有![]() 、
、![]() 、
、![]() ,在B中加入过氧化氢,可生成
,在B中加入过氧化氢,可生成![]() ,调节溶液pH可除去
,调节溶液pH可除去![]() 、
、![]() ,生成氢氧化铁、氢氧化铝沉淀,即固体C,溶液D含有
,生成氢氧化铁、氢氧化铝沉淀,即固体C,溶液D含有![]() ,在溶液D中加入
,在溶液D中加入![]() 和NaOH,发生氧化还原反应,过滤得溶液E含有
和NaOH,发生氧化还原反应,过滤得溶液E含有![]() ,酸化可得
,酸化可得![]() ,溶液经蒸发浓缩、冷却结晶可得
,溶液经蒸发浓缩、冷却结晶可得![]() ,以此解答该题。
,以此解答该题。
![]() 根据以上分析,固体A为
根据以上分析,固体A为![]() ,故答案为:
,故答案为:![]() ;
;
![]() 根据以上分析,实验室中操作
根据以上分析,实验室中操作![]() 的名称为过滤,故答案为:过滤;
的名称为过滤,故答案为:过滤;
![]() 固体C中含有的物质是
固体C中含有的物质是![]() 和
和![]() ,则
,则![]() 的作用是氧化
的作用是氧化![]() ,使铁元素完全转化成沉淀而除去;当
,使铁元素完全转化成沉淀而除去;当![]() 时
时![]() 开始沉淀,室温下,除去
开始沉淀,室温下,除去![]() 溶液中的
溶液中的![]() 、
、![]() ,氢氧化铝完全变成沉淀时的pH:
,氢氧化铝完全变成沉淀时的pH:![]() ,
,![]() ,解得:
,解得:![]() ,
,![]() ,同理
,同理![]() 完全变成沉淀时,pH约为
完全变成沉淀时,pH约为![]() ,故pH范围是:
,故pH范围是:![]() ,故答案为:氧化
,故答案为:氧化![]() ,使铁元素完全转化成沉淀而除去;
,使铁元素完全转化成沉淀而除去;![]() ;
;
![]() 在溶液D中加入
在溶液D中加入![]() 和NaOH,发生氧化还原反应,生成
和NaOH,发生氧化还原反应,生成![]() 和
和![]() ,所以Ⅲ中发生反应的离子方程式为
,所以Ⅲ中发生反应的离子方程式为![]() ,故答案为:
,故答案为:![]() ;
;
![]() Ⅳ中酸化是用硫酸而不用盐酸酸化,原因为
Ⅳ中酸化是用硫酸而不用盐酸酸化,原因为![]() 会氧化盐酸中的氯离子,反应离子方程式为:
会氧化盐酸中的氯离子,反应离子方程式为:![]() ;电解
;电解![]() 溶液制取
溶液制取![]() ,则E电极发生
,则E电极发生![]() ,说明E电极生成氢离子,电极反应为氢氧根失电子发生氧化反应,所以该装置工作时E电极的名称是阳极,B极为正极,A极为负极,电极反应式为
,说明E电极生成氢离子,电极反应为氢氧根失电子发生氧化反应,所以该装置工作时E电极的名称是阳极,B极为正极,A极为负极,电极反应式为![]() ;当电解过程中转移了
;当电解过程中转移了![]() 电子时,则右侧反应消耗
电子时,则右侧反应消耗![]() 氢氧根离子,放出
氢氧根离子,放出![]() 氧气,右侧移动到左侧的钠离子也为
氧气,右侧移动到左侧的钠离子也为![]() ,所以理论上右侧溶液的质量减少
,所以理论上右侧溶液的质量减少![]() ,故答案为:
,故答案为:![]() ;阳;
;阳;![]() ;
;![]() 。
。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】ToC下,向体积为2 L的恒容密闭容器中通入NO2和O2,发生反应:4NO2(g)+O2(g)![]() 2N2O5(g)ΔH<0,部分实验数据如下表。下列说法不正确的是
2N2O5(g)ΔH<0,部分实验数据如下表。下列说法不正确的是
时间/s | 0 | 5 | 10 | 15 |
n(NO2)/mol | 8.00 | n1 | n2 | 4.00 |
n(O2)/mol | 2.00 | 1.25 | 1.00 | n3 |
A. 5s内NO2的平均反应速率为0.3 mol/(Ls)
B. 若10 s时,再向容器中充入2 mol N2O5(g),则新平衡下,NO2的体积分数将增大
C. 若5 s 时,改在绝热恒容下达平衡,新平衡下的平衡常数比原平衡的小
D. ToC,该反应的平衡常数为0.125,反应物的平衡转化率均为50%
【题目】以菱镁矿![]() 主要成分为
主要成分为![]() ,含少量
,含少量![]()
![]() 为原料制备高纯氧化镁的实验流程如下:
为原料制备高纯氧化镁的实验流程如下:

![]() 滤液P中含有的阳离子有 ______。
滤液P中含有的阳离子有 ______。
![]() 过程Ⅱ中发生的氧化还原反应的离子方程式是 ______ 。
过程Ⅱ中发生的氧化还原反应的离子方程式是 ______ 。
![]() 已知:
已知:
|
|
| |
开始沉淀的pH |
|
|
|
沉淀完全的pH |
|
|
|
过程Ⅲ中加入![]() 调节溶液pH约为4,其目的是 ______ 。
调节溶液pH约为4,其目的是 ______ 。
![]() 过程Ⅳ在
过程Ⅳ在![]() 煅烧
煅烧![]() ,发生多个反应,产物除MgO外,还有
,发生多个反应,产物除MgO外,还有![]() 、
、![]() 、CO、S等气体产物,利用右图装置判断煅烧产生的气体。
、CO、S等气体产物,利用右图装置判断煅烧产生的气体。
![]() 中试管壁附着有淡黄色固体,该固体的化学式是 ______ 。
中试管壁附着有淡黄色固体,该固体的化学式是 ______ 。
![]() 中盛放的溶液是
中盛放的溶液是![]() 填字母
填字母![]() ______ 。
______ 。
![]() 溶液
溶液![]() 溶液
溶液 ![]() 稀硝酸
稀硝酸![]() 溶液
溶液
![]() 写出
写出![]() 煅烧
煅烧![]() ,产生气体产物是S和CO的化学方程式 ______ 。
,产生气体产物是S和CO的化学方程式 ______ 。