题目内容
17.酸碱盐在工业生产中应用广泛.(1)实验室中浓硫酸可用于气体干燥剂,原因是它具有吸水性.
(2)熟石灰常用来处理泄漏的硫酸,其原因是(用化学方程式表示)Ca(OH)2+H2SO4=CaSO4+2H2O.
(3)碳酸钠可以用来生产玻璃,具体原理是在高温下,将石英砂(SiO2)与碳酸钠两种固体混合,生成硅酸钠(Na2SiO3)和二氧化碳气体,该反应的化学方程式为Na2CO3+SiO2$\frac{\underline{\;高温\;}}{\;}$Na2SiO3+CO2↑.
分析 (1)浓硫酸具有吸水性,能够吸收气体中吸附的水蒸气;
(2)氢氧化钙与硫酸发生酸碱中和反应生成硫酸钙和水;
(3)碳酸钠与二氧化硅在高温条件下反应生成硅酸钠和二氧化碳.
解答 解:(1)浓硫酸具有吸水性,可用作干燥剂;
故答案为:吸水性;
(2)氢氧化钙与硫酸反应生成硫酸钙和水,方程式为:Ca(OH)2+H2SO4=CaSO4+2H2O;
故答案为:Ca(OH)2+H2SO4=CaSO4+2H2O;
(3)碳酸钠与二氧化硅在高温条件下反应生成硅酸钠和二氧化碳,化学方程式:Na2CO3+SiO2$\frac{\underline{\;高温\;}}{\;}$ Na2SiO3+CO2↑;
故答案为:Na2CO3+SiO2$\frac{\underline{\;高温\;}}{\;}$ Na2SiO3+CO2↑.
点评 本题考查了浓硫酸的性质及化学方程式的熟悉,熟悉浓硫酸、二氧化硅的性质是解题关键,方程式书写应遵循客观事实,注意反应条件,题目难度不大.

练习册系列答案
相关题目
8.已知C3N4晶体可能具有比金刚石还大的硬度,且原子间均以单键结合,下列关于C3N4晶体的说法正确的是( )
| A. | C3N4是分子晶体 | |
| B. | C3N4晶体中微粒通过离子键结合 | |
| C. | C3N4晶体具有导电性和延展性 | |
| D. | C3N4晶体是以C、N原子为基本微粒,共价键为作用力的空间网状结构 |
8.电渗析法是一种利用离子交换膜进行海水淡化的方法,工作原理如图所示.下列有关说法错误的是( )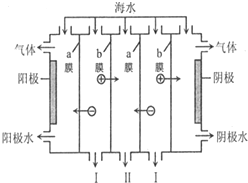

| A. | 阳极可发生电极反应:2Cl--2e-═Cl2↑ | |
| B. | 阴极附近溶液的pH减小 | |
| C. | a膜为阴离子交换膜,b膜为阳离子交换膜 | |
| D. | I、II分别是淡水、浓海水出口 |
5.常温下,有关下列溶液的组成描述合理的是( )
| A. | 中性溶液中可能大量存在:Ca2+,Cl-,SO42-,K+ | |
| B. | 弱酸性溶液中可能大量存在:Cu2+,NH4+,NO3-,Cl- | |
| C. | 使石蕊试液变蓝的溶液中可能大量存在:Na+,Al3+,SO42-,NO3- | |
| D. | 水电离的c(OH-)=10-10mol/L溶液中可能大量存在:l-,NO3-,Mg2+,K+ |
12.氯酸钾(KClO3)中氯元素的化合价为( )
| A. | -1 | B. | +3 | C. | +5 | D. | +7 |
2.下列物质性质与应用对应关系正确的是( )
| A. | 铝合金熔点低,可用来制造门窗 | |
| B. | 二氧化氯具有强氧化性,可用来漂白织物 | |
| C. | 过氧化钠固体呈淡黄色,可用来做供氧剂 | |
| D. | 硫酸铜溶于水呈酸性,可用来做杀菌剂 |