题目内容
6.氮化硼(BN)被称为一种“宇宙时代的材料”,具有很大的硬度.(1)基态硼原子有1个未成对电子,氮离子的电子排布式为1s22s22p6.
(2)部分硼的化合物有以下转化:BNH6$→_{①}^{-4H}$HB$→_{②}^{180-190℃}$B3N3H6,
则下列叙述正确的是BC(填序号);
A.B3N3H6俗称无机苯,但不是平面分子
B.BNH6与乙烷是等电子体
C.HB≡NH中的硼原子、氮原子的杂化类型相同
D.硼、氮、氧三元素的第一电离能比较:B<N<O
(3)如图的晶体结构中,黑球白球分别代表不同的原子、离子或分子,则图1的晶胞中含有的粒子总数为5;图2中的白球的配位数是8.

(4)已知图3、4均表示BN晶体的结构,制备氮化硼的原理为:BCl3+2NH3=BN+2HCl+NH4Cl,当该反应中有1mol BN生成时,则反应中可形成2mol 配位键,比较氮化硼晶体与晶体硅的沸点高低并解释原因氮化硼晶体的熔点比晶体硅的高,B-N键的键能比Si-Si键的键能大.
(5)X射线的衍射实验可获取晶体的结构,包括晶胞形状、大小及原子的分布等参数,从而提供了又一种实验测定阿伏加德罗常数和元素的相对质量的方法.若图4晶胞的边长为a nm,密度为ρ g•cm-3,则阿伏加德罗常数为$\frac{1{0}^{23}}{{a}^{3}ρ}$(要求化为最简关系).
分析 (1)B原子核外电子排布为1s22s22p1;N3-离子核外电子数为10,根据能量最低原理书写;
(2)A.B3N3H6与苯的结构相似;
B.原子总数相同、价电子总数相同(或电子总数相同)的微粒互为等电子体;
C.HB≡NH中的硼原子、氮原子均形成2个σ键,没有孤对电子,杂化轨道数目相同;
D.同周期随原子序数增大,第一电离能呈增大趋势,但N元素原子2p能级容纳3个电子,能量较低,第一电离能高于同周期相邻元素;
(3)利用均摊法计算图1的晶胞中含有的粒子总数;与白色球最近的黑色球处于体心位置,每个顶点白色球为8个晶胞共用;
(4)由图可知,B原子与N原子之间4个共价键,其中一个为配位键,生成1molBN时,得到1molNH4Cl,1个铵根离子中也含有1个配位键;
氮化硼与晶体硅均为原子晶体,键长越短,键能越大,晶体熔点越高;
(5)利用均摊法计算晶胞中B、N原子数目,结合阿伏伽德罗常数表示出晶胞的质量,根据m=ρV计算晶胞的质量,联立关系式可求阿伏伽德罗常数.
解答 解:(1)B原子核外电子排布为1s22s22p1,2p能级的1个电子为未成对电子;N3-离子核外电子数为10,核外电子排布式为1s22s22p6,
故答案为:1;1s22s22p6;
(2)A.B3N3H6与苯为等电子体,结构相似,为平面结构,故A错误;
B.BNH6与乙烷是原子总数相同、电子总数相同,二者互为等电子体,故B正确;
C.HB≡NH中的硼原子、氮原子均形成2个σ键,没有孤对电子,杂化轨道数目均为2,杂化方式sp杂化,故C正确;
D.同周期随原子序数增大,第一电离能呈增大趋势,但N元素原子2p能级容纳3个电子,能量较低,第一电离能高于同周期相邻元素,故第一电离能B<O<N,故D错误,
故选:BC;
(3)图1的晶胞中含有的粒子总数为1+8×$\frac{1}{8}$+6×$\frac{1}{2}$=5;与白色球最近的黑色球处于体心位置,每个顶点白色球为8个晶胞共用,故白色球的配位数为8,
故答案为:5;8;
(4)由图可知,B原子与N原子之间4个共价键,其中一个为配位键,生成1molBN时,形成1mol配位键,同时得到1molNH4Cl,1个铵根离子中也含有1个配位键,故形成配位键为2mol,
氮化硼与晶体硅均为原子晶体,Si原子半径大于B原子、N原子半径,Si-Si键的键长大于B-N键的键长,故B-N键的键能比Si-Si键的键能大,则氮化硼晶体的熔点比晶体硅的高,
故答案为:2;氮化硼晶体的熔点比晶体硅的高,B-N键的键能比Si-Si键的键能大;
越短,键能越大,晶体熔点越高;
(5)晶胞中B原子数目=N原子数目=4,则晶胞质量为$\frac{4×(11+14)}{{N}_{A}}$g,胞的边长为a nm,密度为ρ g•cm-3,则:$\frac{4×(11+14)}{{N}_{A}}$g=(a×10-7cm)3×ρ g•cm-3,整理得NA=$\frac{1{0}^{23}}{{a}^{3}ρ}$,
故答案为:$\frac{1{0}^{23}}{{a}^{3}ρ}$.
点评 本题是对物质结构的考查,涉及核外电子排布、杂化方式、等电子体、电离能、晶体熔沸点比较、晶胞结构及计算等,(3)中白色球配位数为易错点,学生容易认为顶点黑色球与白色球最近,难度中等.

 甲~辛等元素在周期表中的相对物质如下表,甲与戊的原子序数相差3,戊的一种单质是自然界硬度最大的物质,丁与辛属同周期元素,下列判断正确的~( )
甲~辛等元素在周期表中的相对物质如下表,甲与戊的原子序数相差3,戊的一种单质是自然界硬度最大的物质,丁与辛属同周期元素,下列判断正确的~( )| A. | 金属性,甲>乙>丁 | |
| B. | 原子半径,辛>戊>甲 | |
| C. | 形成的最简单氢化物的稳定性,己>戊 | |
| D. | 丙与庚的元素原子核外电子数相差13 |
| A. | 绿色化学的核心是从源头上减少和消除化工生产对环境的污染 | |
| B. | 漂白粉和明矾都常用于自来水的处理,二者的作用和原理不同 | |
| C. | 含次氯酸盐的漂白粉与含盐酸的洁厕灵混合使用会产生有毒气体 | |
| D. | 建筑业使用大量的沙,常使用内陆河的河沙及海洋的海沙 |
| A. | 令人讨厌的地沟油可以用于制肥皂 | |
| B. | 食品中适量添加防腐剂,可以保障安全 | |
| C. | 垃圾分为可回收物、厨余垃圾、有害垃圾、其它垃圾等,废旧电池属于可回收垃圾 | |
| D. | 用红薯酿酒的过程中包含氧化还原反应 |
| A. | pH=l的溶液中:Mg2+、Na+、AlO2-、SO42- | |
| B. | 含有0.1 mol•L-1 Fe3+的溶液中:K+、Mg2+、I-、NO3- | |
| C. | 含有大量NO3-的溶液中:H+、Na+、Fe3+、Cl- | |
| D. | 含有大量Al3+的溶液中:Ca2+、K+、Cl-、HCO3- |
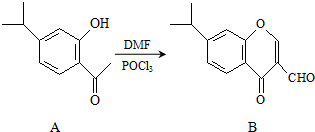 有机物A、B均为合成某种抗支气管哮喘药物的中间体,A在一定条件下可转化为B(如图所示),下列说法正确的是( )
有机物A、B均为合成某种抗支气管哮喘药物的中间体,A在一定条件下可转化为B(如图所示),下列说法正确的是( )| A. | 分子A中所有碳原子均位于同一平面 | |
| B. | 用FeCl3溶液可检验物质B中是否混有A | |
| C. | 物质B既能发生银镜反应,又能发生水解反应 | |
| D. | 1mol B最多可与5mol H2发生加成反应 |
| A. | 溶液一定呈酸性 | B. | 溶液中一定存在:Y2-+H2O?OH-+HY- | ||
| C. | 溶液加水稀释,离子浓度都减小 | D. | 溶液中:c(Na+)≥c(Y2-) |
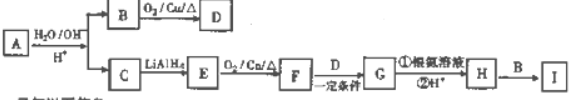
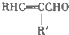 +H2O
+H2O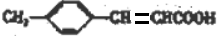 +CH3CH2OH$→_{△}^{浓硫酸}$
+CH3CH2OH$→_{△}^{浓硫酸}$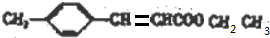 +H2O,反应类型为取代反应(酯化反应).
+H2O,反应类型为取代反应(酯化反应).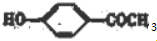 (写结构简式).
(写结构简式).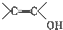 )结构.
)结构.