题目内容
12.氯酸钾(KClO3)中氯元素的化合价为( )| A. | -1 | B. | +3 | C. | +5 | D. | +7 |
分析 根据在化合物中正负化合价代数和为零,结合氯酸钾的化学式进行解答本题.
解答 解:氯酸钾(KClO3)中钾元素显+1价,氧元素显-2价,设氯元素的化合价是x,根据在化合物中正负化合价代数和为零,可得:(+1)+x+(-2)×3=0,则x=+5价,
故选C.
点评 本题元素化合价的判断,掌握利用化合价的原则(化合物中正负化合价代数和为零)计算指定元素的化合价的方法是正确解答本题的关键,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
3.25℃,将Va mL,PH=2的CH3COOH溶液与Vb mL PH=12的NaOH溶液混合,下列说法正确的是( )
| A. | 若Va=Vb,则混合后溶液PH=7 | |
| B. | 若Va<Vb,则混合后溶液PH一定大于7 | |
| C. | 若Va=Vb,则CH3COOH与NaOH完全中和 | |
| D. | 若Va=Vb,混合的溶液中微粒浓度关系可能为c(CH3COO-)>c(Na+)>c(H+)>c(OH-) |
3.把HI气体充入密闭容器中,在一定条件下发生反应:2HI(g)?H2(g)+I2(g),在反应趋向平衡状态的过程中,下列说法正确的是( )
| A. | HI的生成速率等于其分解速率 | |
| B. | HI的生成速率小于其分解速率 | |
| C. | HI的生成速率大于其分解速率 | |
| D. | 无法判断HI的生成速率和分解速率的相对大小 |
20.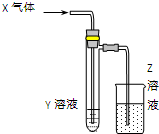 用图所示装置进行如下实验时,实验设计合理、现象描述正确的是( )
用图所示装置进行如下实验时,实验设计合理、现象描述正确的是( )
 用图所示装置进行如下实验时,实验设计合理、现象描述正确的是( )
用图所示装置进行如下实验时,实验设计合理、现象描述正确的是( )| X气体 | Y溶液 | Z溶液 | 试管中现象 | |
| A | NO2 | 硫酸亚铁 | H2O | 溶液颜色变黄 |
| B | CO2 | 氯化钡溶液 | Ca(OH)2 | 白色沉淀 |
| C | Cl2 | 紫色石蕊试液 | NaOH | 石蕊先变红后褪色 |
| D | HCHO | 新制氢氧化铜 | KMnO4 | 砖红色沉淀 |
| A. | A | B. | B、 | C. | C | D. | D |
7.室温下,下列溶液中微粒浓度关系一定正确的是( )
| A. | H2SO4溶液中:c(H+)═c(SO42-)+c(HSO4-)+c(OH-) | |
| B. | 氨水中:c(NH4+)═c(OH-)>c(H+) | |
| C. | a mol•L-1的醋酸与0.01 mol•L-1的氢氧化钠溶液等体积混合后呈中性,则醋酸的Ka=$\frac{1{0}^{-9}}{a-0.01}$ | |
| D. | 0.1 mol•L-1的盐酸与0.2 mol•L-1氨水等体积混合后,溶液中:c(OH-)+c(Cl-)═c(H+)+c(NH3•H2O) |
1.化学与生活息息相关,下列说法不正确的是( )
| A. | 绿色化学的核心是从源头上减少和消除化工生产对环境的污染 | |
| B. | 漂白粉和明矾都常用于自来水的处理,二者的作用和原理不同 | |
| C. | 含次氯酸盐的漂白粉与含盐酸的洁厕灵混合使用会产生有毒气体 | |
| D. | 建筑业使用大量的沙,常使用内陆河的河沙及海洋的海沙 |
2.常温时,将0.1mol Fe(NO3)3和2mol HCl溶于水得2L混合溶液,然后向该溶液投入m克铁粉使其充分反应后,滴加KSCN溶液不变红色.下列有关说法正确的是( )
| A. | 由于氧化性Fe3+>H+,首先发生的反应是:Fe+2Fe3+=3Fe2+ | |
| B. | 当加入16.8 g铁粉时,可生成标准状况下6.72 L气体 | |
| C. | 在铁粉充分反应后的溶液中,铁元素以Fe2+和Fe3+的形式存在 | |
| D. | m至少等于28 g,反应过程中溶液的质量一直在减小 |
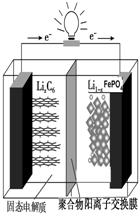 磷酸铁锂动力电池(LiFePO4电池)的内部结构如图所示.中间是聚合物的隔膜,它把正极与负极隔开,锂离子可以通过而电子不能通过.该电池的总反应式为:Li1-xFePO4+LixC6═C6+LiFePO4
磷酸铁锂动力电池(LiFePO4电池)的内部结构如图所示.中间是聚合物的隔膜,它把正极与负极隔开,锂离子可以通过而电子不能通过.该电池的总反应式为:Li1-xFePO4+LixC6═C6+LiFePO4