题目内容
14.设NA是阿伏加德罗常数的值,下列说法正确的是( )| A. | 常温常压下,6.4g O2和O3的混合气体中含有的分子数为0.4 NA | |
| B. | 标准状况下,2.24 L CCl4分子中共价键的数目为0.4NA | |
| C. | 25℃时,pH=13的Ba(OH)2溶液中含有氢氧根离子数为0.1 NA | |
| D. | 高温下,16.8 g Fe与足量水蒸气完全反应失去0.8NA个电子 |
分析 A、极值分析若为氧气分子数为$\frac{6.4g}{32g/mol}$×NA=0.2NA,若全部为臭氧分子数=$\frac{6.4g}{48g/mol}$×NA=0.13NA,混合物含分子数在二者之间;
B、标准状况四氯化碳不是气体;
C、溶液体积不知不能计算微粒数;
D、n=$\frac{m}{M}$计算得到物质的量,结合铁和水蒸气反应生成四氧化三铁和氢气,计算电子转移数;
解答 解:A、极值分析若为氧气分子数为$\frac{6.4g}{32g/mol}$×NA=0.2NA,若全部为臭氧分子数=$\frac{6.4g}{48g/mol}$×NA=0.13NA,混合物含分子数在二者之间,不是0.4NA,故A错误;
B、标准状况四氯化碳不是气体,2.24 L CCl4分子物质的量不是0.1mol,故B错误;
C、溶液体积不知不能计算微粒数,故C错误;
D、n=$\frac{m}{M}$计算得到物质的量=$\frac{16.8g}{56g/mol}$=0.3mol,结合铁和水蒸气反应生成四氧化三铁和氢气计算电子转移数,3Fe~Fe3O4~8e-,则Fe与足量水蒸气完全反应失去0.8NA个电子,故D正确;
故选D.
点评 本题考查了阿伏伽德罗常数的分析应用,主要是气体摩尔体积应用条件分析,氧化还原反应电子转移计算,注意物质的量和微粒数的计算应用,掌握基础是关键,题目较简单.

练习册系列答案
相关题目
5. 化学给人类生活水平和质量的提高,给现代物质文明的进步所作的贡献是我们大家有目共睹的.化学在工业生产中也占有着举足轻重的地位.
化学给人类生活水平和质量的提高,给现代物质文明的进步所作的贡献是我们大家有目共睹的.化学在工业生产中也占有着举足轻重的地位.
(1)N2H4-空气燃料电池是一种碱性人类电池,属于环保型电池,产物无污染.电解质溶液是20%~30%的KOH溶液.则人类电池放电时:正极的电极反应式是O2+2H2O+4e-=4OH-;负极的电极反应式为N2H4+4OH--4e-=4H2O+N2↑;
(2)在波兰沦陷时,波尔为了防止诺贝尔奖章落入敌人手中,用王水将奖章溶解.然后再讲黄金从王水中提取处理,重新铸成奖章.王水是浓硝酸与浓盐酸的混合液,可以溶解金、铂等金属.铂溶于王水时产生[PtCl4]2-和一种无色气体,该气体遇空气变为红棕色,写出该反应的离子方程式3Pt+4NO3-+16H++18Cl-=3[PtCl6]2-+4NO↑+8H2O;
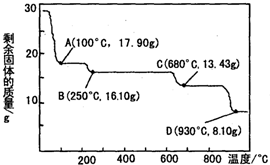
(3)硫酸锌被广泛应用于工农业生产和医药领域.取28.70g ZnSO4•7H2O加热至不同温度,剩余固体的质量变化如图所示,在图中C点,680℃时所得固体的化学式为b(填字母序号).
a.ZnSO4•H2O b.Zn3O(SO4)2 c.ZnSO4 d.ZnO
(4)草酸即乙二酸,是一种有机二元酸,在工业上有重要的作用.已知:
①(NH4)2C2O4溶液的pH<7(填“>”或“<”或“=”).
②当草酸与碳酸钠的物质的量按2:1充分混合后,溶液中pH<7.请将该溶液中离子浓度按由大到小的顺序排列c(Na+)>c(HC2O4-)>c(H+)>c(C2O42-)>c(OH-).
(5)处理工业废水中的铁元素,一般做法都是使之完全转化成Fe3+,并转化成Fe(OH)3沉淀而除去.已知废水中c(Fe3+)=1.0×10-2mol•L-1,要想将其沉淀除去,则应调节溶液pH至少大于2.(已知常温下Fe(OH)3的Knp=1.0×10-38)
 化学给人类生活水平和质量的提高,给现代物质文明的进步所作的贡献是我们大家有目共睹的.化学在工业生产中也占有着举足轻重的地位.
化学给人类生活水平和质量的提高,给现代物质文明的进步所作的贡献是我们大家有目共睹的.化学在工业生产中也占有着举足轻重的地位.(1)N2H4-空气燃料电池是一种碱性人类电池,属于环保型电池,产物无污染.电解质溶液是20%~30%的KOH溶液.则人类电池放电时:正极的电极反应式是O2+2H2O+4e-=4OH-;负极的电极反应式为N2H4+4OH--4e-=4H2O+N2↑;
(2)在波兰沦陷时,波尔为了防止诺贝尔奖章落入敌人手中,用王水将奖章溶解.然后再讲黄金从王水中提取处理,重新铸成奖章.王水是浓硝酸与浓盐酸的混合液,可以溶解金、铂等金属.铂溶于王水时产生[PtCl4]2-和一种无色气体,该气体遇空气变为红棕色,写出该反应的离子方程式3Pt+4NO3-+16H++18Cl-=3[PtCl6]2-+4NO↑+8H2O;
(3)硫酸锌被广泛应用于工农业生产和医药领域.取28.70g ZnSO4•7H2O加热至不同温度,剩余固体的质量变化如图所示,在图中C点,680℃时所得固体的化学式为b(填字母序号).
a.ZnSO4•H2O b.Zn3O(SO4)2 c.ZnSO4 d.ZnO
(4)草酸即乙二酸,是一种有机二元酸,在工业上有重要的作用.已知:
| 电离方程式 | 电离常数 |
| H2C2O4?H++HC2O4- | K1=5.4×10-2 |
| HC2O4-?H++C2O42- | K2=5.4×10-5 |
| NH3•H2O?NH4++OH- | K=1.8×10-5 |
②当草酸与碳酸钠的物质的量按2:1充分混合后,溶液中pH<7.请将该溶液中离子浓度按由大到小的顺序排列c(Na+)>c(HC2O4-)>c(H+)>c(C2O42-)>c(OH-).
(5)处理工业废水中的铁元素,一般做法都是使之完全转化成Fe3+,并转化成Fe(OH)3沉淀而除去.已知废水中c(Fe3+)=1.0×10-2mol•L-1,要想将其沉淀除去,则应调节溶液pH至少大于2.(已知常温下Fe(OH)3的Knp=1.0×10-38)
2.卤代烃有者广泛的应用.下列说法正确的是( )
| A. | 多氯代甲烷中分子结构为正四面体的是CH2Cl2 | |
| B. | 氯代甲烷在常温下均为液体 | |
| C. | 乙烯可用于制取1,2-二氯乙烷和乙醇,前者为加成反应,后者为水解反应 | |
| D. | 麻醉剂三氟氯溴乙烷(CF3CHClBr)的同分异构体有3种(不考虑立体异构) |
9.下列说法正确的是( )
| A. | 地沟油和矿物油都属于酯类物质 | |
| B. | 在食品袋中放入盛有硅胶和铁粉的透气小袋,可防止食物受潮、氧化变质 | |
| C. | 为测定熔融氢氧化钠的导电性,将氢氧化钠固体放在石英坩埚中加热熔化 | |
| D. | 蛋白质、棉花、淀粉、油脂都是由高分子组成的物质 |
6.仅用下表提供的仪器(夹持仪器和试剂任选),不能实现相应实验目的是( )
| 选项 | 实验目的 | 仪器 |
| A | 从食盐水中获得NaCl晶体 | 蒸发皿、玻璃棒、酒精灯 |
| B | 用稀H2SO4、Na2CO3溶液比较元素S与C的非金属性强弱 | 试管、胶头滴管 |
| C | 用8.0mol.L-1的盐酸配制 250mL1.5mol.L-1的盐酸 | 250m容量瓶,玻璃棒、烧杯 |
| D | 测定NaOH溶液的物质的量浓度 | 酸(碱)式滴定管,胶头滴管、锥形瓶、烧杯 |
| A. | A | B. | B | C. | C | D. | D |
4.下列离子组在指定溶液中能大量共存的是( )
| A. | 碱性溶液:Cu2+、Fe3+、NO3-、SO42- | |
| B. | 加入苯酚显紫色的溶液:K+、NH4+、Cl-、I- | |
| C. | 加入Al能放出大量H2的溶液中:NH4+、Fe2+、NO3-、SO42- | |
| D. | 常温下,$\frac{c({H}^{+})}{c(O{H}^{-})}$=1×10-12的溶液:K+、AlO2-、CO32-、Na+ |
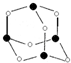 主族元素X、Y、Z、M、N的原子序数依次增大,X、Z、M分属于3个不同的周期,X、M元素可以形成负一价离子,Y原子的各能层电子数相同,Z原子最外层电子数是次外层的3倍,N元素原子的4p轨道上有3个未成对电子.
主族元素X、Y、Z、M、N的原子序数依次增大,X、Z、M分属于3个不同的周期,X、M元素可以形成负一价离子,Y原子的各能层电子数相同,Z原子最外层电子数是次外层的3倍,N元素原子的4p轨道上有3个未成对电子. ,该元素的名称是铍.气态分子YM2的立体构型直线型,YM2可形成多聚体(YM2)n的原因是BeCl2分子中Be与另外两个BeCl2分子的Cl原子形成配位键.
,该元素的名称是铍.气态分子YM2的立体构型直线型,YM2可形成多聚体(YM2)n的原因是BeCl2分子中Be与另外两个BeCl2分子的Cl原子形成配位键.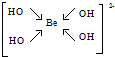 ,1mol该离子中含有的共价键数目为8NA.
,1mol该离子中含有的共价键数目为8NA.