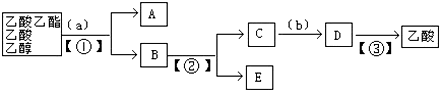
题目内容
2.在空气中放置一段时间的KOH经分析知其中含水a%,含K2CO3b%,其余为KOH.取此样品mg溶于100mL浓度为1mol/L的H2SO4中,所得溶液中剩余的H2SO4需加ngKOH才能完全中和,然后将溶液蒸干,可得固体物质(不含结晶水)的质量为( )| A. | 3.1(m+n)g | B. | 14.2g | C. | 17.4g | D. | 20.6g |
分析 最后固体产物为K2SO4,根据硫酸根守恒可知n(K2SO4)=n(H2SO4),再根据m=nM计算K2SO4的质量.
解答 解:最后固体产物为K2SO4,根据硫酸根守恒可知n(K2SO4)=n(H2SO4)=0.1L×1mol/L=0.1mol,故蒸干所得K2SO4的质量为0.1mol×174g/mol=17.4g,故选C.
点评 本题考查混合物的有关计算,难度不大,利用硫酸根元素守恒计算简化计算步骤,注意守恒思想的运用.

练习册系列答案
 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案
相关题目
16.已知短周期元素的离子,A2+,B+,C3-,D- 都具有相同的电子层结构,则下列叙述正确的是( )
| A. | 离子半径C>D>B>A | B. | 原子序数D>C>B>A | ||
| C. | 原子半径A>B>D>C | D. | 单质的还原性A>B>D>C |
一定条件下,通过下列反应可以制备特种陶瓷的原料M gO: MgSO4(s)+ CO(g)  MgO(s)+ CO2(g)+SO2(g)△H>0该反应在恒容的密闭容器中达到平衡后,若仅改变图中横坐标x的值,重新达到平衡后,纵坐标y随x变化趋势合理的是
MgO(s)+ CO2(g)+SO2(g)△H>0该反应在恒容的密闭容器中达到平衡后,若仅改变图中横坐标x的值,重新达到平衡后,纵坐标y随x变化趋势合理的是
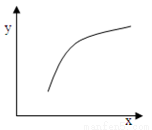
选项 | x | y |
A | 温度 | 容器内混合气体的密度 |
B | CO的物质的量 | CO2与CO的物质的量之比 |
C | SO2的浓度 | 平衡常数K |
D | MgSO4的质量(忽略体积) | CO的转化率 |
17.向200mL 18mol/L H2SO4溶液中加入足量的铜片,加热使之反应,则充分反应后,被还原的H2SO4的物质的量可能是( )
| A. | 1.5mol | B. | 1.81mol | C. | 2.5mol | D. | 3.6mol |
7.下列物质的说法不正确的是( )
| A. | 天然气的主要成份是乙烯,芳香烃主要来自于煤的干馏后的煤焦油 | |
| B. | 研究有机物一般要经过的基本步骤为:分离、提纯→元素定量分析(确定实验式)→测定相对分子质量(确定分子式)→波谱分析(确定结构式),其中最早提出元素定量分析的是德国化学家李比希 | |
| C. | 汽油、煤油、柴油主要来自于石油的常压蒸馏和石油的催化裂化 | |
| D. | 乙烷、丙烷中的化学键既有极性键又有非极性键 |
11.某化合物由C、H两种元素组成,其中含碳的质量分数85.7%,在标准状况下,11.2L此化合物气体的质量为14g.则此化合物的分子式为( )
| A. | C2H4 | B. | C3H6 | C. | C6H6 | D. | CH4 |
12.对如图装置的叙述错误的是( )
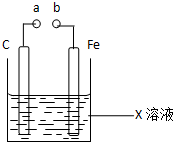

| A. | X如果是Fe2(SO4)3,则不论a和b是否用导线连接成通路,铁片均发生氧化反应 | |
| B. | X如果是CuSO4,a和b分别连接直流电源正、负极,一段时间后铁片质量增加 | |
| C. | X如果是HCl,则不论a和b用导线连接还是a和b分别连接直流电源的正、负极时,H+的移动方向均相同 | |
| D. | X如果是NaCl,则a和b连接时,该装置可模拟生铁在食盐水中被腐蚀的过程 |