题目内容
14.以下是分离乙酸乙酯、乙酸、乙醇的混合物的流程图,图中圆括号内是适当的试剂,方括号内是适当的分离方法,方框内是有关物质的名称.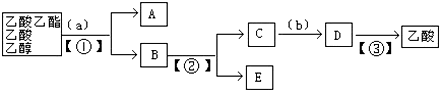
(1)a为饱和Na2CO3溶液,操作①②③分别为分液、蒸馏、蒸馏.
(2)写出下列物质的结构简式ACH3COOCH2CH3; ECH3CH2OH;
(3)F与乙酸乙酯互为同分异构体,它能跟NaHCO3反应放出CO2,则其结构有2种,其用核磁共振仪处理能得到三种峰的是(写结构简式)(CH3)2CHCOOH,其峰的面积之比6:1:1;
(4)从混有少量泥沙和食盐的苯甲酸固体中提取苯甲酸晶体,请写出简略的实验步骤:加热溶解、热过滤、冷却结晶.
分析 由分离流程可知,分离乙酸乙酯、乙酸和乙醇的混合物,加入饱和碳酸钠溶液,乙酸乙酯不溶于饱和碳酸钠,采用分液的方法即可,水层中的乙酸钠要用硫酸反应得到乙酸,再蒸馏得到乙酸,以此来解答.
解答 解:(1)乙酸乙酯是不溶于水的物质,乙醇和乙酸均是易溶于水的,乙酸和乙醇的碳酸钠水溶液是互溶的,分离品乙酸乙酯、乙酸和乙醇的混合物,加入a为饱和碳酸钠溶液,实现酯与乙酸和乙醇的分离,分离油层和水层采用①分液的方法.对水层中的乙酸钠和乙醇进一步分离时应采取②蒸馏操作分离出乙醇,然后水层中的乙酸钠,根据强酸制弱酸,要用试剂b浓硫酸反应得到乙酸,再③蒸馏得到乙酸,
故答案为:饱和Na2CO3溶液;分液;蒸馏;蒸馏;
(2)由上述分析可知,A为CH3COOCH2CH3,E为CH3CH2OH,故答案为:CH3COOCH2CH3;CH3CH2OH;
无水碳酸钠粉末是一种良好的吸水剂,可以除掉乙酸乙酯中混有的少量水,故答案为:除去乙酸乙酯中混有的少量水;
(3)F与乙酸乙酯互为同分异构体,它能跟NaHCO3反应放出CO2,则F含-COOH,丙基有2种,则丁酸有2种,核磁共振仪处理能得到三种峰的是(CH3)2CHCOOH,其峰的面积之比为6:1:1,
故答案为:2;(CH3)2CHCOOH;6:1:1;
(4)苯甲酸的溶解度受温度影响大,室温下,苯甲酸的溶解度较小,温度升高,苯甲酸的溶解度增大,所以升温有利于提高苯甲酸的溶解度,在过滤时要趁热过滤除去泥沙,可以减少过滤时苯甲酸的损失,待过滤完则静置、缓慢冷却至室温,使苯甲酸以晶体形式析出.
故答案为:加热溶解、热过滤、冷却结晶.
点评 本题考查混合物分离提纯的实验设计,为高频考点,侧重于有机物知识的综合应用,为高频考点,把握混合物分离流程、分离方法及发生的反应等为解答的关键,侧重分析与应用能力的考查,题目难度不大.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| 物质 | HF | H2CO3 | HClO |
| 电离平衡常数(Ka) | 7.2×10-4 | Kal=4.4×10-7 Ka2=4.7×10-11 | 3.0×10-8 |
mol-1 ②H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ•mol-1
氢氟酸的电离方程式及热效应可表示为HF(aq)?H+(aq)+F-(aq)△H=-10.4KJ•mol-1.
(2)将浓度为0.1mol•L-1的HF溶液加水稀释一倍(假设温度不变),下列各项中的值将增大的是CD.
A.c(H+) B.c(H+)•c(OH-) C.$\frac{c(H+)}{c(HF)}$ D.$\frac{c(OH-)}{c(H+)}$
(3)下列方法中,可以使0.10mol•L-1 HF溶液中HF电离程度增大的是d.(请填字母且注意区分大小写,大小写填错不得分)
a.升高温度
b.向溶液中滴入2滴浓盐酸
c.加入少量NaF固体
d.加水稀释.
| A. | 一定是甲醛 | B. | 可能是乙醛 | ||
| C. | 混合物中二者的质量比是1:3 | D. | 不可能有此种醛 |
| A. | 3.1(m+n)g | B. | 14.2g | C. | 17.4g | D. | 20.6g |
| A. | CH2=CH-CH2-CH2-CH2-CH3 | B. | HC≡C-CH2-CH2-CH2-CH3 | ||
| C. |  | D. | 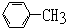 |
| A. | H2O2 | B. | MgF2 | C. | NaOH | D. | Na2O2 |
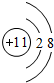
 ,D单质能与水反应化学方程式是2Na+2H2O=2NaOH+H2↑.
,D单质能与水反应化学方程式是2Na+2H2O=2NaOH+H2↑.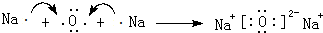 .
.