题目内容
11.标准状况下的6.4g甲烷气体的体积为8.96L,其物质的量为0.4mol,则该气体相对分子质量为16;所含甲烷分子为2.408×1023个.分析 根据n=$\frac{m}{M}=\frac{N}{{N}_{A}}$,进行计算求解.
解答 解:6.4g甲烷的物质的量为:$\frac{6.4g}{16g/mol}$=0.4mol,所以分子数为0.4mol×6.02×1023个/mol=2.408×1023,相对分子质量为16,故答案为:0.4mol;16;2.408×1023.
点评 本题考查混合物的计算,题目难度不大,注意有关计算公式的运用.

练习册系列答案
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案
相关题目
9.某白色粉末其成分可能是碳酸钠和亚硫酸钠的一种或两种组成.请完成对该白色粉末成分的探究(可供选用的实验仪器及试剂如下).

(1)提出合理假设
假设1:该白色粉末成分为碳酸钠;
假设2:该白色粉末成分为亚硫酸钠;
假设3:该白色粉末成分为碳酸钠和亚硫酸钠的混合物.
(2)从上述仪器和试剂中选择合适的组合,一次性判断出该白色粉末的组成,其最佳连接顺序是:a-f-g-b-c-d-e(每组选用仪器和试剂限用一次).
(3)根据(2)的连接顺序进行实验,填写相应现象.

(1)提出合理假设
假设1:该白色粉末成分为碳酸钠;
假设2:该白色粉末成分为亚硫酸钠;
假设3:该白色粉末成分为碳酸钠和亚硫酸钠的混合物.
(2)从上述仪器和试剂中选择合适的组合,一次性判断出该白色粉末的组成,其最佳连接顺序是:a-f-g-b-c-d-e(每组选用仪器和试剂限用一次).
(3)根据(2)的连接顺序进行实验,填写相应现象.
| 假设方案编号 | 相应现象 |
| 假设1 | 品红试液不褪色,澄清石灰水变浑浊 |
| 假设2 | 品红试液褪色,澄清石灰水不变浑浊 |
| 假设3 | 品红试液褪色,酸性高锰酸钾溶液颜色变浅(或不褪色),澄清石灰水变浑浊 |
6.CO(g)与H2O(g)反应的能量变化如图所示,有关两者反应的说法正确的是( )
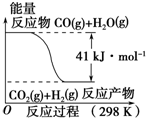

| A. | 该反应为吸热反应 | |
| B. | CO(g)和H2O(g)具有的总能量大于CO2(g)和H2(g)具有的总能量 | |
| C. | 该反应不需要加热就能进行 | |
| D. | 1 mol CO2(g)和1 mol H2(g)反应生成1 mol CO(g)和1 mol H2O(g)要放出41 kJ热量 |
16.下列叙述正确的是( )
| A. | 1molH2O的质量是18g/mol | |
| B. | CH4的摩尔质量是16g | |
| C. | 3.01×1023个CO2分子的质量是22g | |
| D. | 标准状况下,1mol任何物质的体积均为22.4L |
3.下列实验操作中错误的是( )
| A. | 分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 | |
| B. | 蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处 | |
| C. | 蒸发操作时,应使混合物中的水分完全蒸干后,才能停止加热 | |
| D. | 萃取操作时,应选择有机萃取剂 |
20.下列所述实验操作中,正确的是( )
| A. | 测定溶液的pH时,先将pH试纸用蒸馏水润湿,再测量 | |
| B. | 制取蒸馏水时,为防止烧瓶内产生暴沸现象,先向烧瓶中加入几片碎瓷片,再加热 | |
| C. | 分液时,先将分液漏斗中下层液体从下口放出,再将上层液体从下口放出 | |
| D. | 配制硫酸溶液时,可先在量筒中加入一定体积的水,再在搅拌下慢慢加入浓硫酸 |

 ,含有离子键和共价键(填化学键类型),属于离子化合物 (填“离子化合物”或“共价化合物”)
,含有离子键和共价键(填化学键类型),属于离子化合物 (填“离子化合物”或“共价化合物”)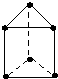 新合成的一种烃,其碳架呈三棱柱体(如图所示),小黑点表示碳原子,氢原子未标出.
新合成的一种烃,其碳架呈三棱柱体(如图所示),小黑点表示碳原子,氢原子未标出. .
.