题目内容
20.下列所述实验操作中,正确的是( )| A. | 测定溶液的pH时,先将pH试纸用蒸馏水润湿,再测量 | |
| B. | 制取蒸馏水时,为防止烧瓶内产生暴沸现象,先向烧瓶中加入几片碎瓷片,再加热 | |
| C. | 分液时,先将分液漏斗中下层液体从下口放出,再将上层液体从下口放出 | |
| D. | 配制硫酸溶液时,可先在量筒中加入一定体积的水,再在搅拌下慢慢加入浓硫酸 |
分析 A.pH试纸用蒸馏水湿润,会减低待测液溶液的浓度;
B.加入碎瓷片,可防止液体暴沸;
C.分液时注意防止液体污染;
D.量筒不能用于配制溶液.
解答 解:A.pH试纸用蒸馏水湿润,会减低待测液溶液的浓度,使结果不准确,故A错误;
B.对于液体的加热,沸腾时易暴沸,加入碎瓷片,可防止液体暴沸,故B正确;
C.为防止液体污染,分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出,故C错误;
D.量筒不能用于配制溶液,应改为烧杯中进行,故D错误.
故选B.
点评 本题考查化学实验的基本操作,题目难度不大,注意相关基本实验操作的实验注意事项.

练习册系列答案
 小夫子全能检测系列答案
小夫子全能检测系列答案
相关题目
8.在用海带提取碘的实验中,进行萃取和分液操作时要用到的仪器是( )
| A. | 分液漏斗 | B. | 普通漏斗 | C. | 烧瓶 | D. | 蒸发皿 |
12.某同学在实验室中进行如下实验:
以下结论正确的是( )
| 编号 | Ⅰ | Ⅱ | Ⅲ |
| 实验 |  |  |  |
| 现象 | 没有明显变化 | 有沉淀生成,溶液为蓝色 | 有无色气体放出 |
| A. | Ⅰ中无明显变化,说明两溶液无离子反应 | |
| B. | Ⅱ中的白色沉淀为CuCl2 | |
| C. | Ⅱ中生成的BaSO4沉淀不是电解质 | |
| D. | Ⅲ中的离子方程式为2H++Zn═Zn2++H2↑ |
9.下列关于金属钠的叙述中,正确的是( )
| A. | 钠暗灰色固体 | |
| B. | 将金属钠在空气中加热则生成白色固体 | |
| C. | 钠投入到Fe2(SO4)3溶液中,钠先与H2O反应,钠投入到稀H2SO4中,钠也是先与H2O反应 | |
| D. | 钠钾合金在室温下呈液态,可用做原子反应堆的导热剂 |
10.下列关于原子的描述中,不正确的是( )
| A. | 汤姆生发现原子中存在电子 | |
| B. | 某金属元素原子失去电子时只能形成一种阳离子 | |
| C. | 原子是化学变化中的最小微粒 | |
| D. | 每个质子和中子的相对质量都约为1 |

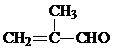 ;J的结构简式为
;J的结构简式为 .
. +
+ $?_{△}^{浓硫酸}$
$?_{△}^{浓硫酸}$ +H2O.
+H2O. ,Cl-
,Cl-