题目内容
12.下表为元素周期表的一部分,a、b、c…为部分元素.回答下列问题:
(1)请写出b在元素周期表中的位置第二周期VA族
(2)请写出实验室制备ba3的化学方程式Ca(OH)2+2NH4Cl═CaCl2+2NH3↑+2H2O;
(3)①d和g的气态氢化物中,较稳定的是HF(写化学式)
②e和f的最高价氧化物对应水化物中,碱性较强的是NaOH(写化学式)
③以上7种元素中原子半径最大的是Na(写元素符号)
(4)请写出 e2c2的电子式
 ,含有离子键和共价键(填化学键类型),属于离子化合物 (填“离子化合物”或“共价化合物”)
,含有离子键和共价键(填化学键类型),属于离子化合物 (填“离子化合物”或“共价化合物”)(5)5.4克f单质与足量a、c、e三种元素形成的化合物水溶液反应产生气体的体积6.72 L(标准状况下).
分析 根据元素在周期表中的相对位置可知,a为H元素、b为N元素、c为O元素、d为F元素、e为Na元素、f为Al元素、g为Cl元素,
(1)b为N元素,其原子序数为7,在周期表中位于第二周期VA族;
(2)ba3为氨气,实验室中用氢氧化钙与氯化铵加热反应制取氨气;
(3)①非金属性越强,气态氢化物越稳定;
②金属性越强,再根据氧化物对应的水化物的碱性越强;
③电子层越多,原子半径越大,电子层相同时,原子序数越大,原子半径越小;
(4)e2c2为过氧化钠,过氧化钠为离子化合物,化学式中存在离子键和共价键;
(5)f为Al,a、c、e三种元素形成的化合物为NaOH,铝与强氧化钠反应生成偏铝酸钠、氢气,根据电子守恒计算出生成氢气的物质的量,最后根据V=nVm计算出标况下氢气的体积.
解答 解:根据元素在周期表中的相对位置可知,a为H元素、b为N元素、c为O元素、d为F元素、e为Na元素、f为Al元素、g为Cl元素
(1)b为N元素,其位于周期表中第二周期VA族,
故答案为:二;VA;
(2)ba3为氨气,实验室中制取氨气的反应方程式为:Ca(OH)2+2NH4Cl═CaCl2+2NH3↑+2H2O,
故答案为:Ca(OH)2+2NH4Cl═CaCl2+2NH3↑+2H2O;
(3)①F的非金属性大于Cl,则HF的稳定性大于HCl,
故答案为:HF;
②e为Na、f为Al,金属性越强,则再根据氧化物对应水化物的碱性越强,由于金属性:Na>Al,所以二者碱性较强的为NaOH,
故答案为:NaOH;
③电子层越多,原子半径越大,则Na、Al、Cl的原子半径较大,Na、Al、Cl的电子层相同,核电荷数越大,原子半径越小,则原子半径最大的为Na,
故答案为:Na;
(4)e2c2为过氧化钠,过氧化钠属于离子化合物,其电子式为: ;过氧化钠中既含有离子键也含有共价键,
;过氧化钠中既含有离子键也含有共价键,
故答案为: ; 离子键和共价键;离子化合物;
; 离子键和共价键;离子化合物;
(5)5.4g铝的物质的量为:$\frac{5.4g}{27g/mol}$=0.2mol,a、c、e三种元素形成的化合物为NaOH,铝与氢氧化钠溶液反应生成偏铝酸钠和氢气,0.2mol铝完全反应生成氢气的物质的量为:$\frac{0.2mol×3}{2}$=0.3mol,标况下0.3mol氢气的体积为:22.4L/mol×0.3mol=6.72L,
故答案为:6.72.
点评 本题考查了元素周期表和元素周期律的综合应用,题目难度中等,明确元素周期表结构、元素周期律内容为解答关键,试题知识点较多、综合性较强,充分考查学生的分析能力及灵活应用能力.

| 编号 | Ⅰ | Ⅱ | Ⅲ |
| 实验 |  |  |  |
| 现象 | 没有明显变化 | 有沉淀生成,溶液为蓝色 | 有无色气体放出 |
| A. | Ⅰ中无明显变化,说明两溶液无离子反应 | |
| B. | Ⅱ中的白色沉淀为CuCl2 | |
| C. | Ⅱ中生成的BaSO4沉淀不是电解质 | |
| D. | Ⅲ中的离子方程式为2H++Zn═Zn2++H2↑ |
 .
.
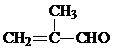 ;J的结构简式为
;J的结构简式为 .
. +
+ $?_{△}^{浓硫酸}$
$?_{△}^{浓硫酸}$ +H2O.
+H2O.
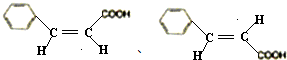
 ;
; ;
; 的最合理的方案.用合成反应流程图表示,书写模式如下:
的最合理的方案.用合成反应流程图表示,书写模式如下: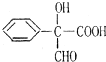


 +NaOH$→_{△}^{醇}$
+NaOH$→_{△}^{醇}$ +NaCl+H2O(注明反应条件).
+NaCl+H2O(注明反应条件).

 .
. .
. .
.