题目内容
9.某白色粉末其成分可能是碳酸钠和亚硫酸钠的一种或两种组成.请完成对该白色粉末成分的探究(可供选用的实验仪器及试剂如下).
(1)提出合理假设
假设1:该白色粉末成分为碳酸钠;
假设2:该白色粉末成分为亚硫酸钠;
假设3:该白色粉末成分为碳酸钠和亚硫酸钠的混合物.
(2)从上述仪器和试剂中选择合适的组合,一次性判断出该白色粉末的组成,其最佳连接顺序是:a-f-g-b-c-d-e(每组选用仪器和试剂限用一次).
(3)根据(2)的连接顺序进行实验,填写相应现象.
| 假设方案编号 | 相应现象 |
| 假设1 | 品红试液不褪色,澄清石灰水变浑浊 |
| 假设2 | 品红试液褪色,澄清石灰水不变浑浊 |
| 假设3 | 品红试液褪色,酸性高锰酸钾溶液颜色变浅(或不褪色),澄清石灰水变浑浊 |
分析 (1)根据“某白色粉末其成分可能是碳酸钠和亚硫酸钠的一种或两种组成”提出可能的第三种假设情况;
(2)从上述仪器和试剂中选择合适的组合,一次性判断出该白色粉末的组成,其最佳连接顺序是先检验二氧化硫的存在,再除去二氧化硫,最后通入澄清石灰水,检验二氧化碳的生成;
(3)假设1通过检验是否生成二氧化碳气体判断是否存在碳酸钠,
假设2利用二氧化硫的漂白性检验是否存在亚使硫酸钠;
假设3品红试液褪色,用高锰酸钾溶液除去二氧化硫后,通入澄清石灰水变浑浊证明含有碳酸钠.
解答 解:(1)某白色粉末其成分可能是碳酸钠和亚硫酸钠的一种或两种组成,所以可能的情况有三种:该白色粉末成分为亚硫酸钠、该白色粉末成分为碳酸钠、该白色粉末成分为碳酸钠和亚硫酸钠的混合物,依据假设1:该白色粉末成分为碳酸钠;假设2:该白色粉末成分为亚硫酸钠;得到假设3:该白色粉末成分为碳酸钠和亚硫酸钠的混合物,
故答案为:该白色粉末成分为碳酸钠和亚硫酸钠的混合物;
(2)从上述仪器和试剂中选择合适的组合,一次性判断出该白色粉末的组成,其最佳连接顺序是先检验二氧化硫的存在,再除去二氧化硫,最后通入澄清石灰水,检验二氧化碳的生成,连接为a-f-g-b-c-d-e,
故答案为:f-g-b-c-d-e;
(3)先用药匙取适量白色粉末于试管中,加入适量H2SO4,将产生的气体通入盛有品红试液的试管中,若品红试液不褪色,澄清石灰水变浑浊,证明混合物中不存在亚硫酸钠,该白色粉末成分为碳酸钠,则假设1成立,
若品红试液褪色,澄清石灰水不变浑浊,证明混合物中存在亚硫酸钠,则假设2成立;
品红试液褪色,酸性高锰酸钾溶液颜色变浅(或不褪色),澄清石灰水变浑浊,则假设3成立,
故答案为:
| 假设方案编号 | 相应现象 |
| 假设1 | 品红试液不褪色,澄清石灰水变浑浊 |
| 假设2 | 品红试液褪色,澄清石灰水不变浑浊 |
| 假设3 | 品红试液褪色,酸性高锰酸钾溶液颜色变浅(或不褪色),澄清石灰水变浑浊 |
点评 本题考查了探究物质的组成、测量物质的含量的方法,该题是高考中的常见题型,属于中等难度的试题.试题综合性强,侧重对学生能力的培养和训练,有利于培养学生规范严谨的实验设计、操作能力. 该类理论和实践的联系紧密,有的还提供一些新的信息,这就要求学生必须认真、细致的审题,联系所学过的知识和技能,进行知识的类比、迁移、重组,全面细致的思考才能得出正确的结论.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 热稳定性:HCl>H2Se>HBr | B. | 还原性:Se2->S2->Cl- | ||
| C. | 原子半径:Se>Cl>P | D. | 酸性:H2SeO4>H2SO4>H3PO4 |
| A. | 分液漏斗 | B. | 普通漏斗 | C. | 烧瓶 | D. | 蒸发皿 |
| A. | 钠暗灰色固体 | |
| B. | 将金属钠在空气中加热则生成白色固体 | |
| C. | 钠投入到Fe2(SO4)3溶液中,钠先与H2O反应,钠投入到稀H2SO4中,钠也是先与H2O反应 | |
| D. | 钠钾合金在室温下呈液态,可用做原子反应堆的导热剂 |

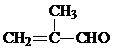 ;J的结构简式为
;J的结构简式为 .
. +
+ $?_{△}^{浓硫酸}$
$?_{△}^{浓硫酸}$ +H2O.
+H2O.

 +NaOH$→_{△}^{醇}$
+NaOH$→_{△}^{醇}$ +NaCl+H2O(注明反应条件).
+NaCl+H2O(注明反应条件).

 .
. .
. .
. 有机物A的结构简式为
有机物A的结构简式为 ,它可通过不同化学反应分别制得B、C和D三种物质.
,它可通过不同化学反应分别制得B、C和D三种物质. .
. +Br2→
+Br2→ .
.