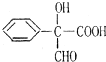
题目内容
6.CO(g)与H2O(g)反应的能量变化如图所示,有关两者反应的说法正确的是( )
| A. | 该反应为吸热反应 | |
| B. | CO(g)和H2O(g)具有的总能量大于CO2(g)和H2(g)具有的总能量 | |
| C. | 该反应不需要加热就能进行 | |
| D. | 1 mol CO2(g)和1 mol H2(g)反应生成1 mol CO(g)和1 mol H2O(g)要放出41 kJ热量 |
分析 A、根据反应物和生成物的能量相对大小判断;
B、根据反应热和物质具有能量的关系来回答判断;
C、某些放热反应也需要加热发生;
D、考虑正反应反应热和逆反应反应热的关系
解答 解:A、从图示可知,反应物能量高生成物能量低,所以该反应为放热反应,故A错误;
B、从图示可知,反应物的能量高,生成物能量低,CO(g)与H2O(g)所具有的总能量大于 CO2(g)与H2(g)所具有的总能量,故B正确;
C、某些放热反应也需要加热发生,如铝热反应,故C错误;
D、从图示可知,正反应为放热反应,则逆反应为吸热反应,故D错误;
故选:B.
点评 本题考查化学反应中的能量变化与图象分析,明确反应热的表示方法、热化学反应方程式的书写即可解答,要明确正逆反应的反应热大小相等,符号相反.

练习册系列答案
相关题目
18.下列溶液中与100mL 1mol/L NaCl溶液中c(Cl-) 相同的是( )
| A. | 100 mL 1 mol/L AlCl3溶液 | B. | 200 mL 1 mol/L MgCl2溶液 | ||
| C. | 100 mL 0.5 mol/L CaCl2溶液 | D. | 100 mL 2 mol/L KCl溶液 |
16.在下列变化中,有共价键被破坏的是( )
| A. | 碘升华 | B. | HCl溶于水 | ||
| C. | Zn跟硫酸铜溶液发生反应 | D. | 电解熔融NaCl |
 .
.
 ;
; ;
; 的最合理的方案.用合成反应流程图表示,书写模式如下:
的最合理的方案.用合成反应流程图表示,书写模式如下: