题目内容
3.下列实验操作中错误的是( )| A. | 分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 | |
| B. | 蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处 | |
| C. | 蒸发操作时,应使混合物中的水分完全蒸干后,才能停止加热 | |
| D. | 萃取操作时,应选择有机萃取剂 |
分析 A.分液时避免上下层液体混合;
B.根据温度计在该装置中的蒸馏测定馏分的温度;
C.蒸发应利用余热加热;
D.利用在不同溶剂中的溶解性差异分离为萃取.
解答 解:A.分液漏斗是用于分离不相溶且不反应的液体的,避免上下层液体混合,上层从上倒出,下层从下流出,故A正确;
B.蒸馏时温度计的水银球在支管口处测的蒸汽的温度,故B正确;
C.蒸发时,应使混合物中的水分部分蒸干后,停止加热,用余热蒸干其余水分,不能将溶液蒸干,故C错误;
D.利用溶质在互不相溶的溶剂里溶解度不同分离混合物,即萃取时,溶剂要互不相溶,溶质在两种溶剂中的溶解度相差很大,故D正确.
故选C.
点评 本题考查物质分离、提纯方法及选择,为高频考点,把握物质的性质及性质差异为解答的关键,侧重化学基本实验操作、实验操作能力的考查,注重培养学生严格的实验态度,题目难度不大.

练习册系列答案
 一本好题口算题卡系列答案
一本好题口算题卡系列答案
相关题目
18.下列溶液中与100mL 1mol/L NaCl溶液中c(Cl-) 相同的是( )
| A. | 100 mL 1 mol/L AlCl3溶液 | B. | 200 mL 1 mol/L MgCl2溶液 | ||
| C. | 100 mL 0.5 mol/L CaCl2溶液 | D. | 100 mL 2 mol/L KCl溶液 |
8.在用海带提取碘的实验中,进行萃取和分液操作时要用到的仪器是( )
| A. | 分液漏斗 | B. | 普通漏斗 | C. | 烧瓶 | D. | 蒸发皿 |
12.某同学在实验室中进行如下实验:
以下结论正确的是( )
| 编号 | Ⅰ | Ⅱ | Ⅲ |
| 实验 |  | 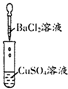 | 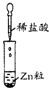 |
| 现象 | 没有明显变化 | 有沉淀生成,溶液为蓝色 | 有无色气体放出 |
| A. | Ⅰ中无明显变化,说明两溶液无离子反应 | |
| B. | Ⅱ中的白色沉淀为CuCl2 | |
| C. | Ⅱ中生成的BaSO4沉淀不是电解质 | |
| D. | Ⅲ中的离子方程式为2H++Zn═Zn2++H2↑ |
13.同温、同压下,决定气体体积的主要因素是( )
| A. | 气体分子的直径 | B. | 气体的分子数目 | ||
| C. | 气体分子间的平均距离 | D. | 气体分子的摩尔质量 |