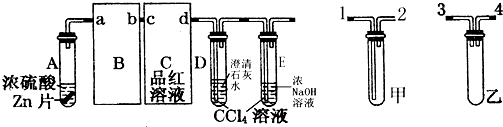
题目内容
16. 草酸(H2C2O4)是一种重要的化工产品.草酸晶体的组成可用H2C2O4•xH2O表示,为了测定x值进行如下实验:
草酸(H2C2O4)是一种重要的化工产品.草酸晶体的组成可用H2C2O4•xH2O表示,为了测定x值进行如下实验:①称取1.260g纯草酸晶体,将其配制成100.00mL水溶液为待测液;
②取25.00mL所配制的草酸溶液置于锥形瓶内,加入适量稀H2SO4后,用浓度为0.1 000mol/L的KMnO4标准溶液进行滴定.试回答:
(1)实验中需要用到的玻璃仪器有:滴定管、100mL量筒、烧杯、胶头滴管、锥形瓶、玻璃棒,其中还缺少的仪器有(填名称及规格)100mL,该反应原理为2MnO4-+5H2C2O4+6H+=10CO2↑+2Mn2++8H2O(用离子方程式表示)
(2)滴定时,将KMnO4标准液装在如图中的甲(选填“甲”或“乙”)滴定管中,达到滴定终点的现象是滴入最后一滴KMnO4溶液变成紫色(或红色)且半分钟不褪色.
(3)在滴定过程中若用去0.1 000mol/L的KMnO4溶液10.00mL(已取三次平均值),则所配制的草酸溶液的物质的量浓度为0.1000mol/L,由此可计算x的值是2.
(4)①若在接近滴定终点时,用少量蒸馏水将锥形瓶内壁冲洗一下,再继续滴定至终点,则所测得x值会无变化(选填“偏大”、“偏小”或“无变化”,下同).
②若滴定终点时仰视滴定管刻度,则由此测得的x值会偏小.
分析 (1)为了配制准确浓度的草酸溶液,所需要的实验仪器主要有天平(含砝码)、烧杯、药匙、100mL容量瓶、胶头滴管、玻璃棒等;高锰酸钾与草酸反应生成二氧化碳、硫酸锰和水;
(2)KMnO4溶液呈紫色,草酸反应完毕,滴入最后一滴KMnO4溶液,紫色不褪去,滴定到终点,因高锰酸钾具有强氧化性,应装在酸式滴定管中;
(3)根据反应方程式计算草酸的物质的量,进而可计算浓度;
(4)滴定时为减小实验误差,应用少量蒸馏水将锥形瓶内壁冲洗,滴定终点时仰视滴定管刻度,会导致测量体积偏大,测定草酸质量偏大,则x值会偏小.
解答 解:(1)根据实验操作步骤可知,应需要的实验仪器主要有天平(含砝码)、烧杯、药匙、100mL容量瓶、胶头滴管、玻璃棒等,所给仪器中缺少100mL容量瓶;
高锰酸钾与草酸、硫酸反应生成二氧化碳、硫酸锰、硫酸钾和水,其反应的离子方程式为:2MnO4-+5H2C2O4+6H+=10CO2↑+2Mn2++8H2O;
故答案为:100mL容量瓶;2MnO4-+5H2C2O4+6H+=10CO2↑+2Mn2++8H2O;
(2)高锰酸钾具有强氧化性,应装在酸式滴定管中,草酸与酸性高锰酸钾发生氧化还原反应,当滴定到终点时,二者恰好完全反应,再滴入一滴KMnO4溶液变成紫色(或红色)且半分钟不褪色,可说明达到滴定终点,
故答案为:甲;滴入最后一滴KMnO4溶液变成紫色(或红色)且半分钟不褪色;
(3)n(KMnO4)=0.1000mol/L×0.01L=0.001000mol,
设草酸浓度为c,则有$\frac{0.025c}{0.001000}$=$\frac{5}{2}$,
则c=0.1000mol/L,
根据n=$\frac{m}{M}$计算,有$\frac{1.260g}{(90+18x)g/mol}$=0.1mol/L×0.1L,
解得x=2,
故答案为:0.1000;2;
(4)①滴定时为减小实验误差,应用少量蒸馏水将锥形瓶内壁冲洗,使草酸完全反应,所以用少量蒸馏水将锥形瓶内壁冲洗一下,对实验结果无影响,
故答案为:无变化;
②滴定终点时仰视滴定管刻度,会导致测量体积偏大,测定草酸质量偏大,则x值会偏小,
故答案为:偏小.
点评 本题考查了氧化还原滴定法的应用,注意氧化还原滴定的反应原理与中和滴定不同,但实验原理及操作和所用仪器等类似.由于该反应有明显的颜色变化,故可不可用指示剂,题目难度中等.

 阅读快车系列答案
阅读快车系列答案| A. | 氮分子的电子式: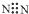 | B. | 硫原子的结构示意图: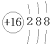 | ||
| C. | CO2的电子式: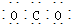 | D. | 水分子的结构式: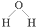 |
| A. | 钠和镁分别与冷水反应,判断金属活动性强弱 | |
| B. | 因为酸性HCl>H2S,判断硫、氯的非金属性强弱 | |
| C. | 稳定性CH4<SiH4,判断硅与碳的非金属活动性强弱 | |
| D. | Br2与I2分别与足量的H2反应,判断溴与碘的非金属活动性强弱 |

(1)榴石矿加盐酸溶解后,溶液里除了Ca2+外,还含有的金属离子是Fe3+、Al3+.
(2)对溶液进行操作时,控制溶液pH=9~10(有关氢氧化物沉淀的pH见下表)NaOH不能过量,若NaOH过量可能会导致Al(OH)3溶解,Ca(OH)2沉淀.
| 氢氧化物 | Fe(OH)3 | Al(OH)3 | Ca(OH)2 |
| 开始沉淀pH | 1.5 | 3.3 | 12.0 |
②若将二氧化碳气体通人澄清石灰水中,石灰 水变浑浊,混合体系中除存在电离平衡、水解平衡外,还存在溶解平衡,用方程式表示CaCO3(s)?Ca2+(aq)+CO32-(aq).
| A. | Ba(OH)2•8H2O与NH4Cl反应 | B. | 铝与稀盐酸反应 | ||
| C. | 灼热的炭与CO2反应 | D. | CO与O2燃烧反应 |