题目内容
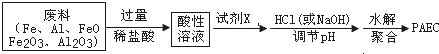
1.高效净水剂聚合氯化铝铁(PAFC)的组成可表示为[AlFe(OH)nCl6-n]m,该物质广泛应用于日常生活用水和工业废水的处理,PAFC中铁元素的化合价为+3.某工厂欲以工业废料(金属铝、铁及其氧化物)为原料制取PAFC,设计如下流程:
①所得酸性溶液中,不能确定是否一定存在的阳离子是C
A、Al3+ B、Fe2+ C、Fe3+ D、H+
若向该酸性的溶液中加入过量的NaOH溶液,写出Al3+转化的离子方程式Al3++4OH-═[Al(OH)4]-;
②试剂X最好是下列中的C;反应的离子方程式是2Fe2++Cl2═2Fe3++2Cl-.
A、Fe B、HNO3 C、氯水 D、Al
③水解形成的聚合物分散在水中的粒子直径在1nm~100nm之间,请用简单的方法验证该分散系的简单方法是用一束光通过混合物,产生丁达尔现象.
分析 该化合物中,Al元素化合价为+3价、Cl元素化合价为-1价、OH-化合价为-1价,化合物中各元素化合价代数和为0,据此判断Fe元素化合价;
废料中加入过量稀盐酸,Fe、Al、FeO、Fe2O3、Al2O3都和稀盐酸反应,导致溶液中溶质为HCl、FeCl2、AlCl3,因为Al、Fe具有还原性、铁离子具有氧化性,所以酸性溶液中不一定含有FeCl3,向溶液中加入试剂X,然后加入HCl或NaOH调节溶液pH,最后水解聚合得到PAEC,PAEC中铁元素化合价为+3价,酸性溶液中含有亚铁离子,试剂X能氧化亚铁离子且不能引进杂质,所以X最好是氯水,据此分析解答.
解答 解:该化合物中,Al元素化合价为+3价、Cl元素化合价为-1价、OH-化合价为-1价,化合物中各元素化合价代数和为0,Fe元素化合价=(6-n)×1+n×1-3×1=+3,
故答案为:+3;
废料中加入过量稀盐酸,Fe、Al、FeO、Fe2O3、Al2O3都和稀盐酸反应,导致溶液中溶质为HCl、FeCl2、AlCl3,因为Al、Fe具有还原性、铁离子具有氧化性,所以酸性溶液中不一定含有FeCl3,向溶液中加入试剂X,然后加入HCl或NaOH调节溶液pH,最后水解聚合得到PAEC,PAEC中铁元素化合价为+3价,酸性溶液中含有亚铁离子,试剂X能氧化亚铁离子且不能引进杂质,所以X最好是氯水;
①加入的盐酸足量,Fe、Al、FeO、Fe2O3、Al2O3都和稀盐酸反应,导致溶液中溶质为HCl、FeCl2、AlCl3,因为Al、Fe具有还原性、铁离子具有氧化性,所以酸性溶液中不一定含有FeCl3;铝离子和足量氢氧根离子反应生成四羟基合铝酸根离子,离子方程式为Al3++4OH-═[Al(OH)4]-,
故答案为:C;Al3++4OH-═[Al(OH)4]-;
②酸性溶液中含有亚铁离子,试剂X能氧化亚铁离子且不能引进杂质,所以X最好是氯水,铁、Al没有氧化性,硝酸具有氧化性但产生新的杂质,故选氯水,亚铁离子和氯气反应生成氯化铁,离子方程式为2Fe2++Cl2═2Fe3++2Cl-,
故答案为:C;2Fe2++Cl2═2Fe3++2Cl-;
③水解形成的聚合物分散在水中的粒子直径在1nm~100nm之间,则该分散系为胶体,胶体具有丁达尔效应,其检验方法为用一束光通过混合物,产生丁达尔现象,
故答案为:用一束光通过混合物,产生丁达尔现象.
点评 本题考查混合物的分离和提纯,为高频考点,涉及氧化还原反应、胶体性质、离子反应等知识点,明确流程图中发生的反应及溶液中溶质及其性质是解本题关键,注意除杂时不能产生新的杂质,为易错点.

| A. | CO、NO、NaH、N2 | |
| B. | SO2、N${\;}_{2}^{+}$、N${\;}_{3}^{-}$、CNO- | |
| C. | CO${\;}_{3}^{2-}$、NO${\;}_{3}^{-}$、BeCl2 | |
| D. | SiF4、SiO${\;}_{4}^{4-}$、SO${\;}_{4}^{2-}$、PO${\;}_{4}^{3-}$ |
| 湿法 | 强碱介质中,Fe(NO3)3与NaClO反应得到紫红色高铁酸盐溶液 |
| 干法 | Fe2O3、KNO3、KOH混合加热共熔生成紫红色高铁酸钾(K2FeO4)和KNO2等产物 |

①反应I的化学方程式为2NaOH+Cl2═NaCl+NaClO+H2O.
②反应Ⅱ的离子方程式为3ClO-+10 OH-+2Fe3+=2FeO42-+3Cl-+5H2O.
③已知25℃时Fe(OH)3的Ksp=4.0×10-38,反应Ⅱ后的溶液中c(Fe3+)=4.0×10-5mol•L-1.则需调整pH=3时,开始生成Fe(OH)3沉淀(不考虑溶液体积的变化).
(2)由流程图可见,湿法制备高铁酸钾时,需先制得高铁酸钠,然后再向高铁酸钠溶液中加入饱和KOH溶液,即可析出高铁酸钾.
①已知高铁酸钠和水反应,有Fe(OH)3和O2生成,则高铁酸钠的氧化性比O2强(填“强”或“弱”).
②由以上信息可知:高铁酸钾的溶解度比高铁酸钠小(填“大”或“小”).
(3)高铁酸钾是一种理想的水处理剂,其处理水的原理为高铁酸钾有强氧化性,能杀菌消毒,在水中被还原生成Fe(OH)3胶体、有吸附性起净水作用.
(4)干法制备K2FeO4的反应中氧化剂与还原剂的物质的量之比为3:1.
| A. | 中和滴定实验中,盛装待测液的锥形瓶没有润洗,对实验结果无影响 | |
| B. | 用容量瓶配制一定物质的量浓度的溶液,定容时俯视刻度线,所配溶液浓度偏低 | |
| C. | 用润湿的pH试纸测某溶液的pH,测定结果不一定有误差 | |
| D. | 测定中和热的实验中,将碱液缓慢倒入酸溶液中,所测中和热值偏低 |
| A. | 四氯化碳和水 | B. | 苯和汽油 | C. | 己烷与液溴 | D. | 溴丙烷和水 |

 草酸(H2C2O4)是一种重要的化工产品.草酸晶体的组成可用H2C2O4•xH2O表示,为了测定x值进行如下实验:
草酸(H2C2O4)是一种重要的化工产品.草酸晶体的组成可用H2C2O4•xH2O表示,为了测定x值进行如下实验: