题目内容
17.亚硝酸钠(NaNO2)是一种常用的防腐剂,有咸味,易溶于水,有毒.在320℃时分解生成有刺激性气味的气体,与盐酸作用会放出红棕色气体.亚硝酸钠在食品中的添加量必须严格控制.下列说法不正确的是( )| A. | 可用盐酸鉴别亚硝酸钠和食盐 | |
| B. | 亚硝酸钠可以加到食品中,但添加量要符合规定 | |
| C. | 亚硝酸钠受热分解放出的气体可能是NH3 | |
| D. | 亚硝酸钠由三种元素组成 |
分析 A.NaNO2和盐酸作用会放出红棕色气体,NaCl和稀盐酸不反应;
B.NaNO2具有防腐性,但有毒;
C.根据元素守恒确定生成物;
D.NaNO2由Na、N、O三种元素组成.
解答 解:A.NaNO2和盐酸作用会放出红棕色气体,NaCl和稀盐酸不反应,二者与盐酸混合现象不同,所以可以用盐酸鉴别亚硝酸钠和食盐,故A正确;
B.NaNO2具有防腐性,但有毒,所以亚硝酸钠可以加到食品中,但添加量要符合规定,故B正确;
C.亚硝酸钠中没有H元素,所以其受热分解不能生成氨气,能生成氮的氧化物,故C错误;
D.NaNO2由Na、N、O三种元素组成,亚硝酸钠属于离子晶体,故D正确;
故选C.
点评 本题以亚硝酸钠为载体考查物质鉴别、物质组成、物质性质,明确物质的性质是解本题关键,注意亚硝酸钠的毒性,很多人往往误食亚硝酸钠而产生中毒现象,题目难度不大.

练习册系列答案
 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案
相关题目
8. 甲、乙、丙三种物质均含有铝元素,在溶液中的转化关系如图所示.下列说法正确的是( )
甲、乙、丙三种物质均含有铝元素,在溶液中的转化关系如图所示.下列说法正确的是( )
 甲、乙、丙三种物质均含有铝元素,在溶液中的转化关系如图所示.下列说法正确的是( )
甲、乙、丙三种物质均含有铝元素,在溶液中的转化关系如图所示.下列说法正确的是( )| A. | 若甲是Al,丙是Al(NO3)3,则乙一定是NaAlO2 | |
| B. | 若甲是Al2O3,丙是NaAlO2,则乙一定是Al(NO3)3 | |
| C. | 若甲是Al(NO3)3,丙是NaAlO2,则乙一定是Al(OH)3 | |
| D. | 若甲是Al(OH)3,丙是Al(NO3)3,则乙一定是NaAlO2 |
5.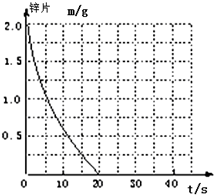 兴趣小组探究锌片与盐酸、醋酸反应时,浓度或温度对反应速率的影响,他们准备了以下化学用品:0.20mol/L与0.40mol/L的HCl溶液、0.2mol/L与0.40mol/L的CH3COOH溶液、0.10mol/L CuCl2、锌片(形状、大小、质量相同)、秒表、碳棒、导线、烧杯、几支试管和胶头滴管,酸液温度控制为298K和308K.
兴趣小组探究锌片与盐酸、醋酸反应时,浓度或温度对反应速率的影响,他们准备了以下化学用品:0.20mol/L与0.40mol/L的HCl溶液、0.2mol/L与0.40mol/L的CH3COOH溶液、0.10mol/L CuCl2、锌片(形状、大小、质量相同)、秒表、碳棒、导线、烧杯、几支试管和胶头滴管,酸液温度控制为298K和308K.
(1)酸液都取足量、相同体积,请你帮助完成以下面实验设计表(表中不要留空格):
(2)若(1)中实验①锌片消失的时间是20s,则锌片剩余质量与时间关系图如上图.假设:该反应温度每升高10℃,反应速率是原来的2倍;温度相同、浓度相同时,醋酸的平均反应速度是盐酸的1/2.请你在此图中大致画出“实验②”(用实线)、“实验④中醋酸实验”(用虚线)的锌片质量与时间关系曲线.
(3)某实验小组在做(1)中实验④时误加少量0.10mol/L CuCl2溶液,发现反应速率与(1)中实验①接近.该组同学对影响因素提出如下假设,请完成假设三:
假设一:Cu2+对该反应起催化剂作用
假设二:Cl-对该反应起催化剂作用
假设三:形成Zn-Cu原电池,加快反应速率(其它答案合理亦可)
…
(4)请你设计实验验证上述假设三是否成立,写出实验步骤及预期现象:
 兴趣小组探究锌片与盐酸、醋酸反应时,浓度或温度对反应速率的影响,他们准备了以下化学用品:0.20mol/L与0.40mol/L的HCl溶液、0.2mol/L与0.40mol/L的CH3COOH溶液、0.10mol/L CuCl2、锌片(形状、大小、质量相同)、秒表、碳棒、导线、烧杯、几支试管和胶头滴管,酸液温度控制为298K和308K.
兴趣小组探究锌片与盐酸、醋酸反应时,浓度或温度对反应速率的影响,他们准备了以下化学用品:0.20mol/L与0.40mol/L的HCl溶液、0.2mol/L与0.40mol/L的CH3COOH溶液、0.10mol/L CuCl2、锌片(形状、大小、质量相同)、秒表、碳棒、导线、烧杯、几支试管和胶头滴管,酸液温度控制为298K和308K.(1)酸液都取足量、相同体积,请你帮助完成以下面实验设计表(表中不要留空格):
| 实验编号 | 温度(K) | 盐酸浓度 | 醋酸浓度 | 实验目的 |
| ① | 298 | 0.20mol/L | / | a.实验①和②是探究不同温度对锌与盐酸反应速率的影响; b.实验①和③是探究不同浓度对锌与盐酸反应速率的影响; c.实验①和④是探究相同温度下,相同浓度的盐酸、醋酸与锌反应速率的区别. |
| ② | 308 | 0.20mol/L | / | |
| ③ | 298 | 0.40mol/L | / | |
| ④ | 298 | / | 0.20 |
(3)某实验小组在做(1)中实验④时误加少量0.10mol/L CuCl2溶液,发现反应速率与(1)中实验①接近.该组同学对影响因素提出如下假设,请完成假设三:
假设一:Cu2+对该反应起催化剂作用
假设二:Cl-对该反应起催化剂作用
假设三:形成Zn-Cu原电池,加快反应速率(其它答案合理亦可)
…
(4)请你设计实验验证上述假设三是否成立,写出实验步骤及预期现象:
| 实验步骤 | 预期现象 |
| ①将不连接的铜、锌电极插入稀硫酸中,②将铜、锌电极用导线连接放入稀硫酸中 | 产生氢气的速率②大于①,证明构成原电池后可以大大加快反应速率 |
12.常温下,下列是生活中常见物质的pH,其中碱性最强的是( )
| A. | 厕所清洁剂pH=1 | B. | 食醋pH=3 | C. | 肥皂水pH=10 | D. | 厨房洗涤剂pH=12 |
9.如图所示装置适用于实验室制氨气并验证氨气的某化学性质,其中能达到实验目的是( )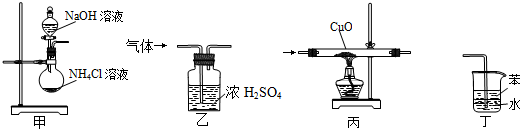

| A. | 用装置甲制取氨气 | B. | 用装置乙除去氨气中的水蒸气 | ||
| C. | 用装置丙验证氨气具有还原性 | D. | 用装置丁吸收氨气 |
6.下列有关叙述,正确的是( )
| A. | 加碘食盐能使淀粉溶液变蓝 | |
| B. | PM2.5是指大气中直径接近于2.5×10-6m的颗粒物,也称细颗粒物,这些细颗粒物分散在空气中形成混合物属于胶体 | |
| C. | 装饰装修材料中的甲醛、芳香烃及放射性物质都会造成室内污染 | |
| D. | 煤经过气化和液化两种物理变化,可变为清洁能源 |
 ;
; ;
; ;
;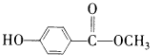 ,
,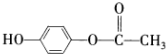 ?
? 太阳能的开发利用在新能源研究中占据重要地位.单晶硅太阳能电池片在加工时,一般掺杂微置的锎、硼、镓、硒等.
太阳能的开发利用在新能源研究中占据重要地位.单晶硅太阳能电池片在加工时,一般掺杂微置的锎、硼、镓、硒等.