题目内容
【题目】碘化钠用作甲状腺肿瘤防治剂、祛痰剂和利尿剂等。实验室用NaOH、单质碘和水合肼(N2H4·H2O)为原料可制备碘化钠。
资料显示:水合肼有还原性,能消除水中溶解的氧气;NaIO3是一种氧化剂。
回答下列问题:
(1)水合肼的制备
有关反应原理为:NaClO + 2NH3 = N2H4·H2O + NaCl。
①用下图装置制取水合肼,其连接顺序为_________(按气流方向,用小写字母表示)。
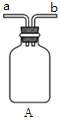
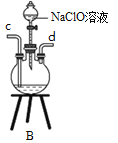
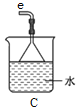
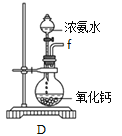
②装置A的作用是_______。
③开始实验时,先向氧化钙中滴加浓氨水,一段时间后再向B的三口烧瓶中滴加NaClO溶液。滴加NaClO溶液时不能过快的理由___________
(2)碘化钠的制备
i. 向三口烧瓶中加入8.4gNaOH及30mL水,搅拌、冷却,加入25.4g碘单质,开动磁力搅拌器,保持60~70℃至反应充分;
ii.继续加入稍过量的N2H4·H2O(水合肼),还原NaIO和NaIO3,得NaI溶液粗品,同时释放一种空气中的气体;
iii.向上述反应液中加入1.0g活性炭,煮沸半小时,然后将溶液与活性炭分离;
iv.将步骤iii分离出的溶液蒸发浓缩、冷却结晶、过滤、洗涤、干燥,得产品24.0g。
④步骤i适宜采用的加热方法是_________, 该步骤反应完全的现象是_________。
步骤ii中IO3-参与反应的离子方程式为________________________________。
⑤步骤iii“将溶液与活性炭分离”的方法是_____________________________。
⑥本次实验产率为__________。实验发现,水合肼实际用量比理论值偏高,可能的原因是________________________________________________。
⑦ 某同学检验产品NaI中是否混有NaIO3杂质。取少量固体样品于试管中,加水溶解,滴加少量淀粉液后再滴加适量稀硫酸,片刻后溶液变蓝。得出NaI中含有NaIO3杂质。请评价该实验结论的合理性___________________________(若认为合理写出离子方程式,若认为不合理说明理由)
【答案】 f a b c d e 防止倒吸或安全瓶 过快滴加NaClO溶液,过量的NaClO溶液氧化水合肼,降低产率 水浴加热 无固体残留且溶液呈无色 2IO3-+ 3N2H4·H2O =3N2↑+2I-+9H2O 趁热过滤 80% 水合肼能与水中的溶解氧反应 可能是I-在酸性环境中被O2氧化成I2而使淀粉变蓝
【解析】(1)①由反应原理NaClO+2NH3=N2H4·H2O+NaCl可知,先用D装置产生氨气,为防止产生倒吸,气体进入装置A中,然后氨气通过c导管进入装置B中,然后次氯酸钠与氨气反应,多余的氨气最后被C装置吸收;其连接顺序为f a b c d e;正确答案:f a b c d e。
②装置A的作用是防止倒吸或安全瓶;正确答案:防止倒吸或安全瓶。
③过快滴加NaClO溶液,导致NaClO不能完全反应,过量的NaClO溶液能够氧化反应产生的水合肼,导致降低产率;正确答案:过快滴加NaClO溶液,过量的NaClO溶液氧化水合肼,降低产率。
(2)④保持60~70℃情况下发生反应,因此可以采用水浴加热的方法;碘固体与氢氧化钠溶液充分反应生成无色的NaIO和NaIO3,最后固体全部消失;所以该步骤反应完全的现象是无固体残留且溶液呈无色;N2H4·H2O具有还原性,能够把IO3-还原为碘离子,而-2价的氮元素被氧化为氮气,离子方程式为:2IO3-+ 3N2H4·H2O =3N2↑+2I-+9H2O;正确答案:水浴加热;固体残留且溶液呈无色;2IO3-+ 3N2H4·H2O =3N2↑+2I-+9H2O。
⑤加入活性炭的目的是对溶液进行脱色,“将溶液与活性炭分离”的方法是趁热过滤;正确答案:趁热过滤。
⑥8.4gNaOH与25.4g单质碘反应,氢氧化钠过量,碘单质反应完全,碘和氢氧化钠发生反应为3I2+6NaOH=5NaI+NaIO3+3H2O,则生成的NaI的质量为![]() =25g,生成的NaIO3与N2H4·H2O反应所得的NaI,反应为3N2H4·H2O+2NaIO3=2NaI+3N2↑+9H2O,则6I2~2NaIO3~2NaI,该步生成的NaI质量为
=25g,生成的NaIO3与N2H4·H2O反应所得的NaI,反应为3N2H4·H2O+2NaIO3=2NaI+3N2↑+9H2O,则6I2~2NaIO3~2NaI,该步生成的NaI质量为![]() =5g,故理论上生成的NaI为25g+5g=30g,所以,本次实验的产率为24/30×100%=80%;水合肼实际用量比理论值偏高,水合肼还原性较强,可能与水中的溶解氧反应;正确答案: 80% ;水合肼能与水中的溶解氧反应。
=5g,故理论上生成的NaI为25g+5g=30g,所以,本次实验的产率为24/30×100%=80%;水合肼实际用量比理论值偏高,水合肼还原性较强,可能与水中的溶解氧反应;正确答案: 80% ;水合肼能与水中的溶解氧反应。
⑦该方案不合理,碘离子具有强还原性,在酸性条件下被氧气氧化生成碘单质,可以使淀粉溶液变蓝;正确答案:可能是I-在酸性环境中被O2氧化成I2而使淀粉变蓝。

 阅读快车系列答案
阅读快车系列答案【题目】十九大报告提出要“打赢蓝天保卫战”,意味对环境污染防治比过去要求更高。
(1)烟气中的氮氧化物与悬浮在大气中海盐粒子的相互作用时,涉及如下反应:
2NO2(g)+NaCl(s)![]() NaNO3(s)+ClNO(g) H < 0 平衡常数K1
NaNO3(s)+ClNO(g) H < 0 平衡常数K1
2NO(g)+Cl2(g)![]() 2ClNO(g) H < 0 平衡常数K2
2ClNO(g) H < 0 平衡常数K2
4NO2(g)+2NaCl(s)![]() 2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K=__________(用K1、K2表示)。
2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K=__________(用K1、K2表示)。
(2)利用CO可将NO转化为无害的N2,其反应:2NO(g)+2CO(g)![]() N2(g)+2CO2(g)。
N2(g)+2CO2(g)。
在容积均为1 L的甲、乙、丙三个恒温(反应温度分别为300℃、T℃、300℃)容器中分别加入物质的量之比为1:1的NO和CO,测得各容器中n(CO)随反应时间t的变化情况如下表所示:
t/min n(CO) /mol | 0 | 40 | 80 | 120 | 160 |
甲 | 2.00 | 1.50 | 1.10 | 0.80 | 0.80 |
乙 | 2.00 | 1.45 | 1.00 | 1.00 | 1.00 |
丙 | 1.00 | 0.80 | 0.65 | 0.53 | 0.45 |
① 甲容器中,0~40min内用NO的浓度变化表示的平均反应速率v(NO)=_______。
② T ___ 300℃,该反应的△H______0(填“>”或“<”)。
③ 甲容器达平衡时α(NO)=_______。
丙容器达平衡时c(NO)可能为________0.4mol/L(填“>”、“=”或“<”)。
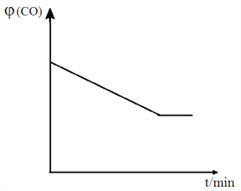
④ 已知甲容器CO的体积分数![]() (CO)随时间t的变化如图,画出其他条件不变,绝热条件下,
(CO)随时间t的变化如图,画出其他条件不变,绝热条件下, ![]() (CO)随时间t的变化示意图。_____________________
(CO)随时间t的变化示意图。_____________________
(3)处理含镉废水常用化学沉淀法。以下是几种镉的难溶化合物25℃时的溶度积常数: Ksp(CdCO3)=5.2×10-12 Ksp(CdS)=3.6×10-29 Ksp(Cd(OH)2)=2.0×10-16,
回答下列问题:
若采用生石灰处理含镉废水最佳pH为11,此时溶液中c(Cd2+)=_________。沉淀Cd2+效果最佳的试剂是____________
a.Na2CO3 b.Na2S c.CaO