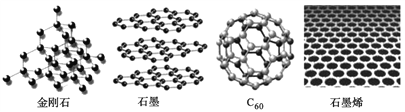
题目内容
【题目】下列给定条件的溶液中,一定能大量共存的离子组是
A. 无色溶液:Ca2+、H+、Cl-、HSO3-
B. 能使pH试纸呈红色的溶液:Na+、NH4+、I-、NO3-
C. FeCl2溶液:K+、Na+、SO42-、NH3·H2O
D. 常温下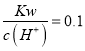 mol·L-1 的溶液:Na+、K+、SiO32-、NO3-
mol·L-1 的溶液:Na+、K+、SiO32-、NO3-
【答案】D
【解析】A、由于亚硫酸氢根离子与氢离子反应生成二氧化硫和水,二者在溶液中不能够大量共存,选项A错误;B、能使pH试纸呈红色的溶液呈酸性,酸性条件下,I-、NO3-发生氧化还原反应而不能大量共存,选项B错误;C、FeCl2与NH3·H2O发生反应产生氢氧化亚铁沉淀而不能大量共存,选项C错误;D、常温下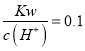 mol·L-1 的溶液呈碱性:Na+、K+、SiO32-、NO3-及氢氧根离子相互之间均不反应,能大量共存,选项D正确。答案选D。
mol·L-1 的溶液呈碱性:Na+、K+、SiO32-、NO3-及氢氧根离子相互之间均不反应,能大量共存,选项D正确。答案选D。

 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案【题目】雷尼镍(Raney-Ni)是一种多孔结构的镍铝合金,对氢气具有强吸附性,是烯烃、炔烃氢化反应的高效催化剂。一种以铜镍渣(主要含Cu、Fe、Co和Ni)生产雷尼镍的流程如下:
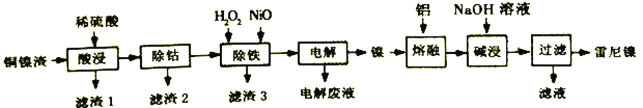
下表列出了有关金属离子生成氢氧化物沉淀的pH:
氢氧化物 | Fe(OH)3 | Fe(OH)2 | Ni(OH)2 |
开始沉淀的pH | 1.5 | 6.5 | 7.7 |
沉淀完全的pH | 3.3 | 9.9 | 9.2 |
(1)“酸浸”时,如通入空气并不断搅拌,可将“滤渣1”氧化溶解,离子方程式为___________。
(2)“除铁”时,先加入适量H2O2氧化Fe2+,理论上消耗的n(H2O2):n(Fe2+)=____;再加入NiO以调节溶液的pH。应控制pH的范围为__________________。
(3)“电解”(以惰性材料作电极)是为了获得单质镍。电解产物中可循环利用的物质是_______。
(4)“碱浸”是为了形成多孔结构的雷尼镍,反应的离子方程式为_________________。使用新制雷尼镍进行氢化反应时,不加氢气也可实现氢化的目的,原因是____________________。
(5)“滤液”主要成分与过量CO2反应的离子方程式为__________________________。