题目内容
【题目】十九大报告提出要“打赢蓝天保卫战”,意味对环境污染防治比过去要求更高。
(1)烟气中的氮氧化物与悬浮在大气中海盐粒子的相互作用时,涉及如下反应:
2NO2(g)+NaCl(s)![]() NaNO3(s)+ClNO(g) H < 0 平衡常数K1
NaNO3(s)+ClNO(g) H < 0 平衡常数K1
2NO(g)+Cl2(g)![]() 2ClNO(g) H < 0 平衡常数K2
2ClNO(g) H < 0 平衡常数K2
4NO2(g)+2NaCl(s)![]() 2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K=__________(用K1、K2表示)。
2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K=__________(用K1、K2表示)。
(2)利用CO可将NO转化为无害的N2,其反应:2NO(g)+2CO(g)![]() N2(g)+2CO2(g)。
N2(g)+2CO2(g)。
在容积均为1 L的甲、乙、丙三个恒温(反应温度分别为300℃、T℃、300℃)容器中分别加入物质的量之比为1:1的NO和CO,测得各容器中n(CO)随反应时间t的变化情况如下表所示:
t/min n(CO) /mol | 0 | 40 | 80 | 120 | 160 |
甲 | 2.00 | 1.50 | 1.10 | 0.80 | 0.80 |
乙 | 2.00 | 1.45 | 1.00 | 1.00 | 1.00 |
丙 | 1.00 | 0.80 | 0.65 | 0.53 | 0.45 |
① 甲容器中,0~40min内用NO的浓度变化表示的平均反应速率v(NO)=_______。
② T ___ 300℃,该反应的△H______0(填“>”或“<”)。
③ 甲容器达平衡时α(NO)=_______。
丙容器达平衡时c(NO)可能为________0.4mol/L(填“>”、“=”或“<”)。
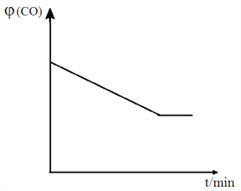
④ 已知甲容器CO的体积分数![]() (CO)随时间t的变化如图,画出其他条件不变,绝热条件下,
(CO)随时间t的变化如图,画出其他条件不变,绝热条件下, ![]() (CO)随时间t的变化示意图。_____________________
(CO)随时间t的变化示意图。_____________________
(3)处理含镉废水常用化学沉淀法。以下是几种镉的难溶化合物25℃时的溶度积常数: Ksp(CdCO3)=5.2×10-12 Ksp(CdS)=3.6×10-29 Ksp(Cd(OH)2)=2.0×10-16,
回答下列问题:
若采用生石灰处理含镉废水最佳pH为11,此时溶液中c(Cd2+)=_________。沉淀Cd2+效果最佳的试剂是____________
a.Na2CO3 b.Na2S c.CaO
【答案】 K= K12/ K2 0.0125mol/(Lmin) ﹥ < 60% ﹥  2.0×10-10mol/L b
2.0×10-10mol/L b
【解析】(1)两个反应2NO2(g)+NaCl(s)NaNO3(s)+ClNO(g) K1 △H1<0 为①,2NO(g)+Cl2(g)2ClNO(g) K2△H2<0 为②,则平衡常数K1=![]() ,平衡常数K2=
,平衡常数K2=![]() ,4NO2(g)+2NaCl(s)2NaNO3(s)+2NO(g)+Cl2(g)可由2×①-②得到,则K=
,4NO2(g)+2NaCl(s)2NaNO3(s)+2NO(g)+Cl2(g)可由2×①-②得到,则K=![]() =
=![]() ;正确答案:K= K12/ K2。
;正确答案:K= K12/ K2。
(2)①甲容器中,根据表中数据,0~40min内,NO的物质的量改变量为△n=2.00﹣1.50=0.50mol,反应经历的时间为△t=40min,容器体积V=1L,根据化学反应平均速率计算公式v(NO)=![]() =
=![]() =0.0125mol/(L·min);正确答案:0.0125mol/(L·min)。
=0.0125mol/(L·min);正确答案:0.0125mol/(L·min)。
②甲和乙,起始物料相同,温度不同,从0~40min看,乙容器的化学反应速率比甲的快,温度升高能加快化学反应速率,因此乙容器的温度大于甲容器的温度(300℃),但乙容器中NO的转化率低于甲容器,因此升高温度,化学平衡向逆反应方向移动,则该反应的正反应是放热反应,焓变△H<0;正确答案:﹥ ; <。
③在容积为1L的甲容器中分别加入物质的量之比为1:1的NO和CO进行反应,根据反应方程式可知,CO的变化量就是NO变化量,因此甲容器中NO的起始物质的量为2.00mol,达到平衡后剩余0.8 mol,NO消耗了1.2 mol,α(NO)=1.2/2×100%=60%;丙容器与甲容器的温度相同,则两容器反应的平衡常数也相同,该反应为2NO(g)+C(s)![]() N2(g)+CO2(g),反应的平衡常数为K=
N2(g)+CO2(g),反应的平衡常数为K=![]() ,根据表中数据,平衡时,c(NO)=
,根据表中数据,平衡时,c(NO)=![]() =0.80mol/L,C(N2)=
=0.80mol/L,C(N2)=![]() =0.60mol/L,c(CO2)=c(N2)=0.60mol/L,则K=
=0.60mol/L,c(CO2)=c(N2)=0.60mol/L,则K=![]() =
=![]() ;设丙中反应达到平衡时c(NO)=xmol/L,容器的体积为1 L,根据反应进行如下计算:
;设丙中反应达到平衡时c(NO)=xmol/L,容器的体积为1 L,根据反应进行如下计算:
2NO(g)+C(s)![]() N2(g)+CO2(g)
N2(g)+CO2(g)
起始浓度 1 0 0
变化浓度 x 0.5 x 0.5x
平衡浓度 1- x 0.5 x 0.5x
根据平衡常数计算公式可知:K=![]() =(0.5 x)2/(1- x)2=9/16,解之得:x=0.6 mol/L>0.4mol/L;正确答案:60% ; ﹥。
=(0.5 x)2/(1- x)2=9/16,解之得:x=0.6 mol/L>0.4mol/L;正确答案:60% ; ﹥。
④ 由于甲中温度小于乙中温度,升高温度,乙中CO的量比甲中得多,说明该反应为放热反应,绝热条件下,由于自身产生的热量不能散发出去,相当于给该反应升温,速率加快,所用时间缩短,平衡左移,CO剩余的多,CO的体积分数![]() (CO)增大,因此其他条件不变
(CO)增大,因此其他条件不变![]() (CO)随时间t的变化示意图如下:
(CO)随时间t的变化示意图如下: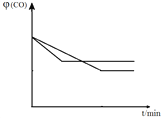 ;正确答案:
;正确答案: 。
。
(3)采用生石灰处理含镉废水最佳pH为11,c(H+)=10-11 mol/L,c(OH-)=10-3mol/L,根据Ksp(Cd(OH)2)=c(Cd2+)×c2(OH-)=(10-3)2×c(Cd2+)=2.0×10-16,c(Cd2+)=2.0×10-10mol/L;根据三种溶度积常数:Ksp(CdCO3)=5.2×10-12,Ksp(CdS)=3.6×10-29,Ksp(Cd(OH)2)= 2.0×10-16可知,Ksp越小,越容易产生沉淀,因此沉淀Cd2+效果最佳的试剂是Na2S,b正确;正确答案:2.0×10-10mol/L; b。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】(14分)某酸性工业废水中含有K2Cr2O7。光照下,草酸(H2C2O4)能将其中的Cr2O72-转化为Cr3+。某课题组研究发现,少量铁明矾[Al2Fe(SO4)4 ·4H2O]即可对该反应起催化作用。为进一步研究有关因素对该反应速率的影响,探究如下:
(1)在25°C下,控制光照强度、废水样品初始浓度和催化剂用量相同,调节不同的初始pH和一定浓度草酸溶液用量,作对比实验,完成以下实验设计表(表中不要留空格)。
实验编号 | 初始pH | 废水样品体积/mL | 草酸溶液体积/mL | 蒸馏水体积/mL |
① | 4 | B= | 10 | 30 |
② | 5 | 60 | 10 | d= |
③ | a= | 60 | c= | 20 |
测得实验①和②溶液中的Cr2O72-浓度随时间变化关系如图所示。
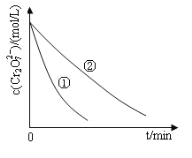
(2)上述反应后草酸被氧化为 (填化学式);
(3)实验①和②的结果表明_______________________________;
(4)该课题组对铁明矾[Al2Fe(SO4)4 ·4H2O]中起催化作用的成分提出如下假设,请你完成假设二和假设三:
假设一:Fe2+起催化作用;假设二: ;假设三: ;……
(5)请你设计实验验证上述假设一,完成下表中内容。(除了上述实验提供的试剂外,可供选择的药品有K2SO4、FeSO4、K2SO4·Al2(SO4)3·24H2O、Al2(SO4)3等。(溶液中Cr2O72-的浓度可用仪器测定)
实验方案(不要求写具体操作过程) | 预期实验结果和结论 |
取_______________________________代替实验①中的铁明矾,控制其他反应条件与实验①相同,进行对比实验 | 反应进行相同时间后, 若溶液中的Cr2O72-浓度____________________________则假设一成立; 若溶液中的Cr2O72-浓度____________________________则假设一不成立; |
(6)铁明矾长期存放,其中的亚铁离子可能会变质。为测定铁明矾中亚铁离子的质量分数。取5.6g铁明矾晶体,将其配制为100ml的溶液,取出20ml置于锥形瓶中。用0.01mol/L的标准KMnO4溶液进行滴定(还原产物为Mn2+),平行做4组实验,得出如下表数值。
组数 | 1 | 2 | 3 | 4 |
消耗V(KMnO4)/ml | 20.04 | 20.00 | 18.90 | 19.96 |
请计算铁明矾中亚铁离子的质量分数: 。若滴定结束后读数时仰视,测定结果 (填“偏大”“不影响”或“偏小”)
【题目】以下非金属氧化物与其引起的环境问题及主要来源对应正确的是( )
氧化物 | 环境问题 | 主要来源 | |
A | CO2 | 酸雨 | 化石燃料的燃烧 |
B | CO | CO中毒 | 汽车尾气和化石燃料的不完全燃烧 |
C | NO2 | 温室效应 | 工厂废气的排放 |
D | SO2 | 光化学烟雾 | 汽车尾气的排放 |
A.A
B.B
C.C
D.D