题目内容
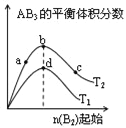
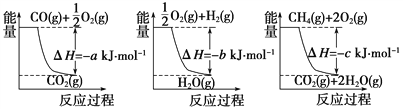
【题目】(1)氨的合成是最重要的化工生产之一,工业上合成氨用的H2有多种制取的方法。用天然气跟水蒸气反应:CH4(g)+H2O(g)![]() CO(g)+3H2(g)。已知有关反应的能量变化如下图所示,则此制取H2反应的ΔH=____________。
CO(g)+3H2(g)。已知有关反应的能量变化如下图所示,则此制取H2反应的ΔH=____________。
(2)已知通常状况下,每充分燃烧1gCO并恢复到原状态,会释放10KJ的热量。请写出表示CO燃烧热的热化学反应方程式:________________________________。
(3)一种甲烷燃料电池是采用铂或碳化钨作为电极催化剂,在稀硫酸电解液中直接通入甲烷,同时向一个电极通入空气。此电池的负极电极反应式是_______________。
(4)利用右图装置可以模拟铁的电化学防护。
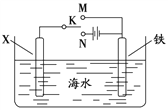
① 若X为碳棒,为减缓铁的腐蚀,开关K应置于______处。假设海水中只有NaCl溶质,写出此时总离子反应方程式:__________________________________________。
② 若X为锌,开关K置于M处,该电化学防护法称为_________。写出铁电极处的电极反应式:_____________________________。
【答案】 ΔH=(a+3b-c) kJ·mol-1 CO(g)+1/2O2(g)=CO2(g) ΔH=-280kJ/mol CH4 -8e- + 2H2O = CO2 + 8H+ N 2Cl-+2H2O![]() 2OH-+H2↑+Cl2↑ 牺牲阳极的阴极保护法 O2+2H2O+4e—=4OH—
2OH-+H2↑+Cl2↑ 牺牲阳极的阴极保护法 O2+2H2O+4e—=4OH—
【解析】试题分析:(1)三个反应的热化学方程式为:①CO(g)+1/2O2(g)=CO2(g) ΔH=-aKJ/mol, ②2H2(g)+O2(g)=2H2O(g) ΔH=-bKJ/mol,③CH4(g)+2O2(g)=CO2(g)+2H2O(g) ΔH=-cKJ/mol,根据盖斯定律分析,三个反应应该①+3×②-③,所以反应热ΔH=(a+3b-c) kJ·mol-1。(2)1克一氧化碳的物质的量为1/28摩尔,所以每摩尔一氧化碳反应生成二氧化碳反应放出的热量为280KJ所以热化学方程式为:CO(g)+1/2O2(g)=CO2(g) ΔH=-280KJ/mol。(3)甲烷在原电池中左负极,在酸性条件下反应生成二氧化碳和水,电极反应为:CH4-8e-+ 2H2O = CO2+ 8H+。(4)①X为碳棒,减缓铁的腐蚀,需要将铁电解池的阴极,即连接N;电解氯化钠,反应生成氢氧化钠和氢气和氯气,离子方程式为:2Cl-+2H2O![]() 2OH-+H2↑+Cl2↑。②X为锌,开关在M处,则铁做原电池的正极,这种电化学防护法为牺牲阳极的阴极保护法; 铁为原电池的正极,发生吸氧腐蚀,电极反应为:O2+2H2O+4e—=4OH—。
2OH-+H2↑+Cl2↑。②X为锌,开关在M处,则铁做原电池的正极,这种电化学防护法为牺牲阳极的阴极保护法; 铁为原电池的正极,发生吸氧腐蚀,电极反应为:O2+2H2O+4e—=4OH—。

 一本好题口算题卡系列答案
一本好题口算题卡系列答案【题目】(14分)某酸性工业废水中含有K2Cr2O7。光照下,草酸(H2C2O4)能将其中的Cr2O72-转化为Cr3+。某课题组研究发现,少量铁明矾[Al2Fe(SO4)4 ·4H2O]即可对该反应起催化作用。为进一步研究有关因素对该反应速率的影响,探究如下:
(1)在25°C下,控制光照强度、废水样品初始浓度和催化剂用量相同,调节不同的初始pH和一定浓度草酸溶液用量,作对比实验,完成以下实验设计表(表中不要留空格)。
实验编号 | 初始pH | 废水样品体积/mL | 草酸溶液体积/mL | 蒸馏水体积/mL |
① | 4 | B= | 10 | 30 |
② | 5 | 60 | 10 | d= |
③ | a= | 60 | c= | 20 |
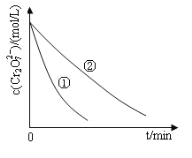
测得实验①和②溶液中的Cr2O72-浓度随时间变化关系如图所示。
(2)上述反应后草酸被氧化为 (填化学式);
(3)实验①和②的结果表明_______________________________;
(4)该课题组对铁明矾[Al2Fe(SO4)4 ·4H2O]中起催化作用的成分提出如下假设,请你完成假设二和假设三:
假设一:Fe2+起催化作用;假设二: ;假设三: ;……
(5)请你设计实验验证上述假设一,完成下表中内容。(除了上述实验提供的试剂外,可供选择的药品有K2SO4、FeSO4、K2SO4·Al2(SO4)3·24H2O、Al2(SO4)3等。(溶液中Cr2O72-的浓度可用仪器测定)
实验方案(不要求写具体操作过程) | 预期实验结果和结论 |
取_______________________________代替实验①中的铁明矾,控制其他反应条件与实验①相同,进行对比实验 | 反应进行相同时间后, 若溶液中的Cr2O72-浓度____________________________则假设一成立; 若溶液中的Cr2O72-浓度____________________________则假设一不成立; |
(6)铁明矾长期存放,其中的亚铁离子可能会变质。为测定铁明矾中亚铁离子的质量分数。取5.6g铁明矾晶体,将其配制为100ml的溶液,取出20ml置于锥形瓶中。用0.01mol/L的标准KMnO4溶液进行滴定(还原产物为Mn2+),平行做4组实验,得出如下表数值。
组数 | 1 | 2 | 3 | 4 |
消耗V(KMnO4)/ml | 20.04 | 20.00 | 18.90 | 19.96 |
请计算铁明矾中亚铁离子的质量分数: 。若滴定结束后读数时仰视,测定结果 (填“偏大”“不影响”或“偏小”)