题目内容
【题目】下表为元素周期表的一部分,请参照元素①-⑨在表中的位置,用化学用语回答下列问题:
族 周期 | IA | 0 | ||||||
1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
2 | ② | ③ | ④ | ⑤ | ||||
3 | ⑥ | ⑦ | ⑧ | ⑨ | ||||
(1)原子半径最小的元素是___(填元素名称),写出⑥的离子结构示意图___。
(2)③的单质的电子式为__。
(3)以上9种元素中最高价氧化物对应水化物酸性最强的是___(填化学式)。
(4)⑤与⑦形成的化合物中,化学键类型为___。
(5)②与④形成的原子个数比为1:2的化合物的结构式为____。
(6)③、④、⑥的原子半径由大到小的顺序为___(用元素符号回答)。
(7)为探究元素②和⑧的非金属性强弱,某同学设计了如图所示的装置进行实验(夹持仪器已略去,装置气密性良好)。请回答:
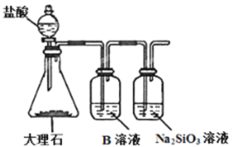
a.溶液B的作用是___。
b.上述实验中,能说明②和⑧非金属性强弱的化学方程式是___。
【答案】氢 ![]()
![]() HClO4 离子键 O=C=O Na>N>O 除去CO2气体中的HCl Na2SiO3+CO2+H2O=Na2CO3+H2SiO3↓或Na2SiO3+2CO2+2H2O=2NaHCO3+H2SiO3↓
HClO4 离子键 O=C=O Na>N>O 除去CO2气体中的HCl Na2SiO3+CO2+H2O=Na2CO3+H2SiO3↓或Na2SiO3+2CO2+2H2O=2NaHCO3+H2SiO3↓
【解析】
根据元素在周期表中的相对位置,①、②、③、④、⑤、⑥、⑦、⑧、⑨代表的元素分别是H、C、N、O、F、Na、Mg、Si、Cl;
(1)电子层数越少,原子半径越小,原子半径最小的元素是氢;⑥是11号元素钠,钠离子核外有10个电子,离子结构示意图是![]() ;
;
(2)③是N元素,N2分子中含有氮氮三键,N2的电子式为![]() ;
;
(3)非金属性越强,最高价氧化物的水化物酸性越强,氟元素没有正价,所以最高价氧化物对应水化物酸性最强的是HClO4;
(4)F与Mg形成离子化合物MgF2,化学键类型为离子键;
(5)C与O形成的原子个数比为1:2的化合物是CO2,结构式为O=C=O。
(6)Na的电子层数最多半径最大,N、O电子层数相同,N质子数大于O,所以原子半径由大到小的顺序为Na>N>O;
(7)根据强酸制弱酸的原理,盐酸和石灰石反应生成二氧化碳,用碳酸氢钠溶液除去氯化氢,通入硅酸钠溶液生成硅酸沉淀,可证明非金属性C大于Si,所以溶液B是碳酸氢钠,作用是除去CO2气体中的HCl;二氧化碳和硅酸钠溶液反应生成硅酸沉淀,能说明非金属性C大于Si,化学方程式是Na2SiO3+CO2+H2O=Na2CO3+H2SiO3↓。

【题目】下表所列各组物质中,物质之间通过一步反应能实现如图所示转化的是( )
X | Y | Z | 物质转化关系 | |
A | Cu | CuO | Cu(OH)2 |
|
B | Si | SiO2 | H2SiO3 | |
C | NaHCO3 | Na2CO3 | NaOH | |
D | FeCl2 | FeO | FeCl3 |
A. A B. B C. C D. D