题目内容
【题目】已知在一定条件下,反应X(g)+3Y(g)![]() 2Z(g) ΔH=-akJ·mol-1(a>0),某实验小组测得X的转化率(α)在不同温度与压强(p)下的实验数据,三者之间关系如图所示。下列说法正确的是( )
2Z(g) ΔH=-akJ·mol-1(a>0),某实验小组测得X的转化率(α)在不同温度与压强(p)下的实验数据,三者之间关系如图所示。下列说法正确的是( )
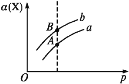
A.图中A、B两点对应的平衡常数相等
B.上述反应在达到平衡后,缩小体积,Y的转化率提高
C.升高温度,正、逆反应速率增大,平衡向正反应方向移动
D.将2.0molX、6.0molY置于密闭容器中发生反应,放出的热量为2akJ
【答案】B
【解析】
A.平衡常数与温度有关,与压强无关,A、B两点温度不同,则平衡常数不同,故A错误;
B.该反应为气体体积减小的反应,增大压强平衡正向移动,Y的转化率提高,故B正确;
C.正反应为放热反应,升高温度平衡逆向移动,且正、逆反应速率均增大,故C错误;
D.可逆反应不能完全转化,且物质的量与热量成正比,则2.0molX、6.0molY置于密闭容器中发生反应,放出的热量小于2a kJ,故D错误。
答案选B。

 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案【题目】下表为元素周期表的一部分,请参照元素①-⑨在表中的位置,用化学用语回答下列问题:
族 周期 | IA | 0 | ||||||
1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
2 | ② | ③ | ④ | ⑤ | ||||
3 | ⑥ | ⑦ | ⑧ | ⑨ | ||||
(1)原子半径最小的元素是___(填元素名称),写出⑥的离子结构示意图___。
(2)③的单质的电子式为__。
(3)以上9种元素中最高价氧化物对应水化物酸性最强的是___(填化学式)。
(4)⑤与⑦形成的化合物中,化学键类型为___。
(5)②与④形成的原子个数比为1:2的化合物的结构式为____。
(6)③、④、⑥的原子半径由大到小的顺序为___(用元素符号回答)。
(7)为探究元素②和⑧的非金属性强弱,某同学设计了如图所示的装置进行实验(夹持仪器已略去,装置气密性良好)。请回答:
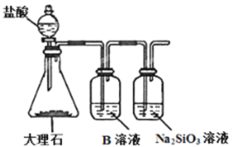
a.溶液B的作用是___。
b.上述实验中,能说明②和⑧非金属性强弱的化学方程式是___。