题目内容
19.海洋约占地球表面积的71%,具有十分巨大的开发潜力,通过海水的综合利用可获得许多物质供人类使用.Ⅰ、海水中制得的氯化钠除食用外,还用作工业原料,例如通常以NaCI、CO2和NH3为原料制取纯碱,请写出第一步制取NaHCO3的化学方程式:NH3+CO2+H2O+NaCl═NaHCO3↓+NH4Cl.
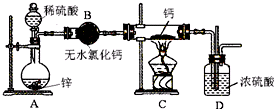
Ⅱ、工业上以浓缩海水为原料提取溴的部分流程如图1:
已知:Br2常温下呈液态,易挥发,有毒:2Br2+3CO32-=5Br-+BrO3-+3CO2.
(1)通过步骤①氯气氧化已获得含Br2的溶液,为何还需经过吹出、吸收、酸化来重新获得含Br2的溶液,原因是富集溴,提高Br2的浓度.
(2)反应釜2中发生反应的离子方程式为5Br-+BrO3-+6H+=3Br2+3H2O.
(3)向蒸馏塔中通入水蒸气加热,控制温度在90℃左右进行蒸馏的原因是温度过低难以将Br2蒸发出来,但温度过高又会将大量的水蒸馏出来.
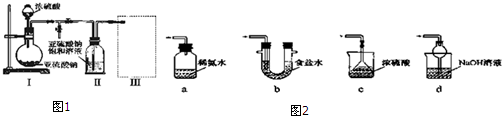
Ⅲ、盐卤蒸发冷却后析出卤块的主要成分是MgCI2,此外还含有Fe2+、Fe3+、Mn2+等离子.以卤块为原料制得镁的工艺流程如图2(部分操作和条件已略去):
生成氢氧化物沉淀的pH
| 物质 | 开始沉淀 | 沉淀完全 |
| Fe(OH)3 | 2.7 | 3.7 |
| Fe(OH)2 | 7.6 | 9.6 |
| Mn(OH)2 | 8.3 | 9.8 |
| Mg(OH)2 | 9.6 | 11.1 |
(2)步骤③需在HCI保护气中加热进行,请用化学平衡移动原理解释原因Mg2++2H2O
 Mg(OH)2+2H+,温度升高,水解程度增大,通入HCl,增加c(H+),使平衡逆向移动,抑制Mg2+水解.HCl还能带出水份,最终得到无水MgCl2.
Mg(OH)2+2H+,温度升高,水解程度增大,通入HCl,增加c(H+),使平衡逆向移动,抑制Mg2+水解.HCl还能带出水份,最终得到无水MgCl2.(3)NaCIO还能除去盐卤中的CO(NH2)2,生成盐和能参与大气循环的物质,除去0.1molCO(NH2)2时消耗NaCIO22.35g.

分析 Ⅰ、阳离子交换膜只能阳离子通过,阴离子和气体不能通过;
Ⅱ、由流程可知,①中发生2Br-+Cl2=2Cl-+Br2,利用空气将吹出塔中含Br2的溶液,经过吹出、吸收、酸化来重新获得含Br2的溶液,其目的是富集溴,提高Br2的浓度,在吸收塔③中的溶液含BrO3-,可知发生3CO32-+3Br2=5Br-+BrO3-+3CO2↑,④中发生5Br-+BrO3-+6H+=3Br2+3H2O,最后利用蒸馏得到溴,以此来解答.
Ⅲ、盐卤加水溶解,加NaClO将Fe2+氧化成Fe3+,然后加入NaOH调节pH为9.8,使Fe2+、Fe3+、Mn2+转化为氢氧化物沉淀,过滤,滤液经过蒸发浓缩、冷却结晶、过滤得到,氯化镁晶体,在HCl气氛中加热得到无水氯化镁,电解熔融的氯化镁得到Mg;
(1)次氯酸钠具有氧化性,把氧化亚铁离子为三价铁,据此写出反应的离子方程式;
(2)镁离子水解显酸性,通入HCl可以抑制其水解;
(3)NaClO还能除去盐卤中的CO(NH2)2,生成盐和能参与大气循环的物质,其反应为3NaClO+CO(NH2)2═3NaCl+CO2↑+N2↑+2H2O,根据方程式计算.
解答 解:Ⅰ、以NaCl、NH3、CO2和水等为原料制取NaHCO3的化学方程式为:NH3+CO2+H2O+NaCl═NaHCO3↓+NH4Cl,
故答案为:NH3+CO2+H2O+NaCl═NaHCO3↓+NH4Cl;
Ⅱ、(1)从①出来的溶液中溴的含量不高,如果直接蒸馏,得到产品成本高,所以经过吹出、吸收、酸化来重新获得含Br2的溶液,其目的为富集溴,提高Br2的浓度,
故答案为:富集溴,提高Br2的浓度;
(2)发生归中反应,离子方程式为:5Br-+BrO3-+6H+=3Br2+3H2O,故答案为:5Br-+BrO3-+6H+=3Br2+3H2O;
(3)温度过高水蒸气蒸出,溴中含有水分,温度过低溴不能完全蒸出,产率低,所以控制温度在90℃左右进行蒸馏,故答案为:温度过低难以将Br2蒸发出来,但温度过高又会将大量的水蒸馏出来;
Ⅲ、盐卤加水溶解,加NaClO将Fe2+氧化成Fe3+,然后加入NaOH调节pH为9.8,使Fe2+、Fe3+、Mn2+转化为氢氧化物沉淀,过滤,滤液经过蒸发浓缩、冷却结晶、过滤得到,氯化镁晶体,在HCl气氛中加热得到无水氯化镁,电解熔融的氯化镁得到Mg;
(1)加入次氯酸钠会氧化亚铁离子为三价铁,则次氯酸钠与Fe2+、H2O反应生成Fe(OH)3、Cl-和H+,反应的离子方程式为:ClO-+2Fe2++5H2O=2Fe(OH)3+Cl-+4H+;
故答案为:ClO-+2Fe2++5H2O=2Fe(OH)3+Cl-+4H+;
(2)镁离子水解生成氢氧化镁和氢离子,Mg2++2H2O?Mg(OH)2+2H+,水解反应属于吸热反应,加热温度升高,水解程度增大,通入HCl时,增加了溶液中的c(H+),能使水解平衡逆向移动,抑制Mg2+水解.HCl还能带出水份,最终得到无水MgCl2;
故答案为:Mg2++2H2O?Mg(OH)2+2H+,温度升高,水解程度增大,通入HCl,增加c(H+),使平衡逆向移动,抑制Mg2+水解.HCl还能带出水份,最终得到无水MgCl2;
(3)NaClO还能除去盐卤中的CO(NH2)2,生成盐和能参与大气循环的物质,其反应为3NaClO+CO(NH2)2═3NaCl+CO2↑+N2↑+2H2O,由方程式中物质之间的关系可知,0.1mol CO(NH2)2消耗NaClO为0.3mol,则m(NaClO)=nM=0.3mol×74.5g/mol=22.35g,故答案为:22.35.
点评 本题考查了方程式的书写、实验仪器的选择、物质的制备原理,涉及知识点较多,题目侧重于反应原理的应用和元素化合物性质的考查,题目综合性较强,难度中等,充分考查了学生的分析、理解能力及化学实验能力.

 阅读快车系列答案
阅读快车系列答案| A. | 稀HCl和稀NaOH | |
| B. | 1.0 mol•L-1 HCl和1.0 mol•L-1 NaOH | |
| C. | 500 mL 2.0 mol•L-1 HCl和500 mL2.0 mol•L-1 NaOH | |
| D. | 500 mL 2.0 mol•L-1 H2SO4和500 mL 2.0 mol•L-1 Ba(OH)2 |
| A. | $\frac{ρ}{22.4}$ mol/L | B. | $\frac{ab}{22400}$ mol/L | ||
| C. | $\frac{ab}{22400+36.5a}$ mol/L | D. | $\frac{1000ab}{22400+36.5a}$ mol/L |
| A. | 将1molCl2通入到水中,则N(HClO)+N(Cl-)+N(ClO-)=2NA | |
| B. | 常温常压下,3.0g含甲醛(HCHO)的冰醋酸中含有的原子总数为0.4NA | |
| C. | 标准状况下,2.24L的苯中含有的σ键数为1.2NA | |
| D. | 将CO2通过Na2O2使其增重a克时,反应中转移电子数为$\frac{a{N}_{A}}{14}$ |
| A. | Na与H2O的反应是熵增的放热反应,该反应能自发进行 | |
| B. | 0.1 mol AgCl和0.1mol AgI混合后加入1 L水中,所得溶液中c(Cl-)=c(I-) | |
| C. | pH=9的CH3COONa溶液和pH=9的NH3•H2O溶液,两溶液中水的电离程度相同 | |
| D. | 25℃时,0.1mol•L-1的硫化氢溶液与等浓度的硫化钠溶液的导电能力相当 |
| A. | 2a2=a1=197 | B. | 197>a1=2a2 | C. | a2>a1>197 | D. | 2a2<a1<197 |