题目内容
11.下列说法正确的是( )| A. | Na与H2O的反应是熵增的放热反应,该反应能自发进行 | |
| B. | 0.1 mol AgCl和0.1mol AgI混合后加入1 L水中,所得溶液中c(Cl-)=c(I-) | |
| C. | pH=9的CH3COONa溶液和pH=9的NH3•H2O溶液,两溶液中水的电离程度相同 | |
| D. | 25℃时,0.1mol•L-1的硫化氢溶液与等浓度的硫化钠溶液的导电能力相当 |
分析 A.该反应为固体与液态反应生成气体,该反应为熵增反应,反应放出大量的热,结合△G=△H-T△S<0,反应自发进行;
B.AgCl与AgI的溶度积不同,所得溶液中c(Cl-)≠c(I-);
C.根据H2O?H++OH-,从影响水的电离平衡移动的角度分析,NH3•H2O抑制水的电离,CH3COONa促进水的电离;
D.硫化氢为弱电解质,而硫化钠为强电解质,等浓度溶液中硫化氢溶液中离子浓度远远小于硫化钠溶液中离子浓度;
解答 解:A.Na与水反应为固体与液态反应生成气体,该反应为熵增反应,即△S>O,反应中钠熔化为小球,说明反应放出大量的热,即△H<0,则△G=△H-T△S<0,故该反应自发进行,故A正确;
B.均存在溶解平衡,溶液中Ag+浓度相同,AgCl与AgI的溶度积不同,所得溶液中c(Cl-)≠c(I-),故B错误;
C.根据H2O?H++OH-,NH3•H2O抑制水的电离,CH3COONa促进水的电离,所以两溶液中水的电离程度不同,故C错误;
D.硫化氢为弱电解质,部分电离,而硫化钠为强电解质,等浓度溶液中硫化氢溶液中离子浓度远远小于硫化钠溶液中离子浓度,硫化氢溶液比等浓度的硫化钠溶液的导电能力弱,故D错误;
故选:A.
点评 本题侧重对化学反应原理考查,涉及反应自发性判断、导电能力的比较、水的电离、沉淀溶解平衡等,难度不大.

练习册系列答案
 探究与巩固河南科学技术出版社系列答案
探究与巩固河南科学技术出版社系列答案
相关题目
10.根据理论研究,元素周期表可容纳164种元素.理论上164号、114号、14号元素位于同一主族.根据你所学知识,下列有关预测肯定不正确的是( )
| A. | 164号元素是金属元素 | |
| B. | 164号元素位于ⅣA族 | |
| C. | 164号元素对应的最高价氧化物的水化物其碱性比114号的强 | |
| D. | 164号元素存在稳定的气态氢化物,且还原性比SiH4弱 |
19.海洋约占地球表面积的71%,具有十分巨大的开发潜力,通过海水的综合利用可获得许多物质供人类使用.
Ⅰ、海水中制得的氯化钠除食用外,还用作工业原料,例如通常以NaCI、CO2和NH3为原料制取纯碱,请写出第一步制取NaHCO3的化学方程式:NH3+CO2+H2O+NaCl═NaHCO3↓+NH4Cl.
Ⅱ、工业上以浓缩海水为原料提取溴的部分流程如图1:
已知:Br2常温下呈液态,易挥发,有毒:2Br2+3CO32-=5Br-+BrO3-+3CO2.
(1)通过步骤①氯气氧化已获得含Br2的溶液,为何还需经过吹出、吸收、酸化来重新获得含Br2的溶液,原因是富集溴,提高Br2的浓度.
(2)反应釜2中发生反应的离子方程式为5Br-+BrO3-+6H+=3Br2+3H2O.
(3)向蒸馏塔中通入水蒸气加热,控制温度在90℃左右进行蒸馏的原因是温度过低难以将Br2蒸发出来,但温度过高又会将大量的水蒸馏出来.
Ⅲ、盐卤蒸发冷却后析出卤块的主要成分是MgCI2,此外还含有Fe2+、Fe3+、Mn2+等离子.以卤块为原料制得镁的工艺流程如图2(部分操作和条件已略去):
生成氢氧化物沉淀的pH
(1)用NaCIO氧化Fe2+得到Fe(OH)3沉淀的离子反应方程式是ClO-+2Fe2++5H2O=2Fe(OH)3+Cl-+4H+.
(2)步骤③需在HCI保护气中加热进行,请用化学平衡移动原理解释原因Mg2++2H2O Mg(OH)2+2H+,温度升高,水解程度增大,通入HCl,增加c(H+),使平衡逆向移动,抑制Mg2+水解.HCl还能带出水份,最终得到无水MgCl2.
Mg(OH)2+2H+,温度升高,水解程度增大,通入HCl,增加c(H+),使平衡逆向移动,抑制Mg2+水解.HCl还能带出水份,最终得到无水MgCl2.
(3)NaCIO还能除去盐卤中的CO(NH2)2,生成盐和能参与大气循环的物质,除去0.1molCO(NH2)2时消耗NaCIO22.35g.

Ⅰ、海水中制得的氯化钠除食用外,还用作工业原料,例如通常以NaCI、CO2和NH3为原料制取纯碱,请写出第一步制取NaHCO3的化学方程式:NH3+CO2+H2O+NaCl═NaHCO3↓+NH4Cl.
Ⅱ、工业上以浓缩海水为原料提取溴的部分流程如图1:
已知:Br2常温下呈液态,易挥发,有毒:2Br2+3CO32-=5Br-+BrO3-+3CO2.
(1)通过步骤①氯气氧化已获得含Br2的溶液,为何还需经过吹出、吸收、酸化来重新获得含Br2的溶液,原因是富集溴,提高Br2的浓度.
(2)反应釜2中发生反应的离子方程式为5Br-+BrO3-+6H+=3Br2+3H2O.
(3)向蒸馏塔中通入水蒸气加热,控制温度在90℃左右进行蒸馏的原因是温度过低难以将Br2蒸发出来,但温度过高又会将大量的水蒸馏出来.
Ⅲ、盐卤蒸发冷却后析出卤块的主要成分是MgCI2,此外还含有Fe2+、Fe3+、Mn2+等离子.以卤块为原料制得镁的工艺流程如图2(部分操作和条件已略去):
生成氢氧化物沉淀的pH
| 物质 | 开始沉淀 | 沉淀完全 |
| Fe(OH)3 | 2.7 | 3.7 |
| Fe(OH)2 | 7.6 | 9.6 |
| Mn(OH)2 | 8.3 | 9.8 |
| Mg(OH)2 | 9.6 | 11.1 |
(2)步骤③需在HCI保护气中加热进行,请用化学平衡移动原理解释原因Mg2++2H2O
 Mg(OH)2+2H+,温度升高,水解程度增大,通入HCl,增加c(H+),使平衡逆向移动,抑制Mg2+水解.HCl还能带出水份,最终得到无水MgCl2.
Mg(OH)2+2H+,温度升高,水解程度增大,通入HCl,增加c(H+),使平衡逆向移动,抑制Mg2+水解.HCl还能带出水份,最终得到无水MgCl2.(3)NaCIO还能除去盐卤中的CO(NH2)2,生成盐和能参与大气循环的物质,除去0.1molCO(NH2)2时消耗NaCIO22.35g.

6.下列化学方程式或离子方程式中正确的是( )
| A. | 金属钠加入无水乙醇中:Na+C2H5OH→C2H5ONa+H2↑ | |
| B. | 过量的乙酸跟Na2CO3溶液反应:2H++CO32-═H2O+CO2↑ | |
| C. | 溴乙烷在NaOH水溶液中加热:CH3CH2Br+NaOH→CH2═CH2↑+NaBr+H2O | |
| D. | 苯酚钠溶液中通入CO2: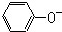 +CO2+H2O→ +CO2+H2O→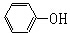 +HCO${\;}_{3}^{-}$ +HCO${\;}_{3}^{-}$ |
16.下列说法正确的是( )
| A. | 原子的最外层电子数相同的元素,一定属于同一族 | |
| B. | 电子层数相同的粒子,对应元素一定属于同一周期 | |
| C. | 元素周期表中元素排序的依据是原子的核电荷数 | |
| D. | 元素周期表中有十六个纵行,也就是十六个族 |
20.某自来水中含有Ca2+、Mg2+、Na+、K+、HCO3-、SO42-、Cl-,长期烧煮上述自来水会在锅炉内形成水垢,锅炉水垢不仅耗费燃料,而且有烧坏锅炉的危险,因此要定期清除锅炉水垢,已知部分物质20℃时的溶解度数据有:
(1)请用化学方程式表示锅炉中的水垢含有Mg(OH)2的原因:Mg(HCO3)2$\frac{\underline{\;\;△\;\;}}{\;}$MgCO3↓+H2O+CO2↑、MgCO3+H2O$\frac{\underline{\;\;△\;\;}}{\;}$Mg(OH)2+CO2↑.
(2)锅炉中的水垢所含有的CaSO4不能直接用酸除去,需要加入试剂X使其转化为易溶于盐酸的物质Y而除去,试剂X是C(填序号).
A.食醋 B.氯化钡 C.碳酸钠 D.碳酸氢钠
CaSO4能转化为物质Y的原因是(用文字叙述)碳酸钙的溶解度小于硫酸钙的溶解度.
(3)除含CaSO4、Mg(OH)2外,锅炉水垢中还可能含有的物质是(写化学式)CaCO3、MgCO3等.
(4)水中的Ca2+、Mg2+可以用一定浓度的M溶液进行测定,M与Ca2+、Mg2+都以等物质的量进行反应,现取含Ca2+浓度为0.40g/L的自来水样10mL至锥形瓶中进行滴定,达到终点时,用去了浓度为0.01mol/L的M溶液20.00mL,则该自来水样中Mg2+的物质的量浓度是0.01 mol/L.
| 物质 | Mg(OH)2 | CaCO3 | MgCO3 | Ca(OH)2 | CaSO4 | MgSO4 |
| 溶解度(g/100g H2O) | 9.0×10-4 | 1.5×10-3 | 1.0×10-2 | 1.7×10-1 | 2.0×10-1 | 26.7 |
(2)锅炉中的水垢所含有的CaSO4不能直接用酸除去,需要加入试剂X使其转化为易溶于盐酸的物质Y而除去,试剂X是C(填序号).
A.食醋 B.氯化钡 C.碳酸钠 D.碳酸氢钠
CaSO4能转化为物质Y的原因是(用文字叙述)碳酸钙的溶解度小于硫酸钙的溶解度.
(3)除含CaSO4、Mg(OH)2外,锅炉水垢中还可能含有的物质是(写化学式)CaCO3、MgCO3等.
(4)水中的Ca2+、Mg2+可以用一定浓度的M溶液进行测定,M与Ca2+、Mg2+都以等物质的量进行反应,现取含Ca2+浓度为0.40g/L的自来水样10mL至锥形瓶中进行滴定,达到终点时,用去了浓度为0.01mol/L的M溶液20.00mL,则该自来水样中Mg2+的物质的量浓度是0.01 mol/L.
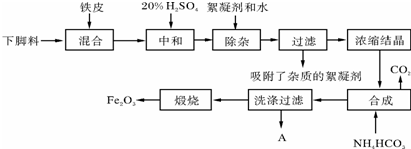
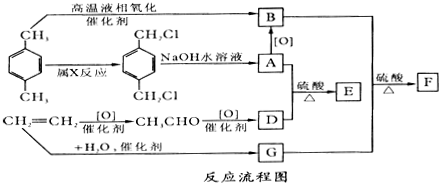
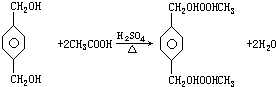 ;B+G→F
;B+G→F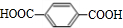 +CH3CH2OH$→_{△}^{浓H_{2}SO_{4}}$
+CH3CH2OH$→_{△}^{浓H_{2}SO_{4}}$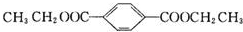 .
.