题目内容
14.焦亚硫酸钠(Na2S2O5)是常用的食品抗氧化剂之一.某研究小组进行如下实验:实验一 焦亚硫酸钠的制取
采用图1装置(实验前已除尽装置内的空气)
制取Na2S2O5.装置 II中有Na2S2O5晶体析出,发生的反应为:Na2SO3+SO2=Na2S2O5
(1)装置 I中产生气体的化学方程式为Na2SO3+H2SO4=Na2SO4+SO2↑+H2O.
(2)要从装置Ⅱ中获得已析出的晶体,可采取的分离方法是过滤.
(3)装置Ⅲ用于处理尾气,可选用的最合理装置(夹持仪器已略去)为d (填序号).
实验二 焦亚硫酸钠的性质
Na2S2O5溶于水即生成NaHSO3.
(4)证明NaHSO3溶液中HSO3- 的电离程度大于水解程度,可采用的实验方法是ae (填序号).
a.测定溶液的pH b.加入Ba(OH)2溶液 c.加入盐酸 d.加入品红溶液
e.用蓝色石蕊试纸检测
(5)检验Na2S2O5晶体在空气中已被氧化的实验方案是取少量Na2S2O5晶体于试管中,加入适量水溶解,滴加盐酸,振荡,再滴加氯化钡溶液,有白色沉淀生成.
实验三 葡萄酒中抗氧化剂残留量的测定
(6)葡萄酒常用Na2S2O5作抗氧化剂.测定某葡萄酒中抗氧化剂的残留量(以游离SO2计算)的方案如下:
葡萄酒样品100.00mL$→_{蒸馏}^{盐酸}$馏分$→_{用0.01000mol•L-}^{运动条件,淀粉溶液}$溶液出现蓝色后,30s不褪色
(已知:滴定时反应的化学方程式为SO2+I2+2H2O=H2SO4+2HI)
①按上述方案实验,消耗标准I2溶液25.00mL,该次实验测得样品中抗氧化剂的残留量(以游离SO2计算)为0.16 g•L-1.
②在上述实验过程中,若有部分HI被空气氧化,则测得结果偏低(填“偏高”“偏低”或“不变”).
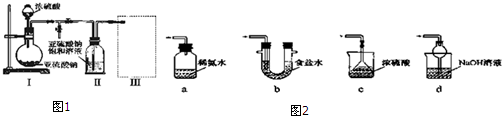
分析 (1)由装置Ⅱ中发生的反应可知,装置Ⅰ中产生的气体为SO2,亚硫酸钠与硫酸反应生成硫酸钠、二氧化硫与水;
(2)装置Ⅱ中获得已析出的晶体,分离固体与液态,应采取过滤操作;
(3)装置Ⅲ用于处理尾气,吸收为反应的二氧化硫,应防止倒吸,且不能处于完全密闭环境中;
(4)NaHSO3溶液中HSO3-的电离程度大于水解程度,溶液呈酸性,故检验溶液呈酸性即可;
(5)Na2S2O5晶体在空气中易被氧化为Na2SO4,用盐酸、氯化钡溶液检验样品中是否含有硫酸根即可;
(6)①由消耗碘的量,结合SO2+I2+2H2O═H2SO4+2HI计算二氧化硫的质量,进而计算浓度;
②若有部分HI被空气氧化,则消耗碘的量偏小,故测定二氧化硫的量偏小.
解答 解:(1)由装置Ⅱ中发生的反应可知,装置Ⅰ中产生的气体为SO2,亚硫酸钠与硫酸反应生成硫酸钠、二氧化硫与水,反应方程式为:Na2SO3+H2SO4=Na2SO4+SO2↑+H2O,
故答案为:Na2SO3+H2SO4=Na2SO4+SO2↑+H2O;
(2)装置Ⅱ中获得已析出的晶体,分离固体与液态,应采取过滤进行分离,
故答案为:过滤;
(3)a.装置应将导管深入氨水中可以吸收二氧化硫,但为密闭环境,装置内压强增大易产生安全事故,故错误;
b.该装置吸收二氧化硫能力较差,且为密闭环境,装置内压强增大易产生安全事故,故错误;
c.该装置不能吸收二氧化硫,所以无法实现实验目的,故错误;
d.该装置中氢氧化钠与二氧化硫反应,可以吸收,且防止倒吸,故正确;
故答案为:d;
(4)NaHSO3溶液中HSO3-的电离程度大于水解程度,溶液呈酸性,测定溶液的pH,可以确定溶液酸碱性,酸性溶液可以使湿润蓝色石蕊试纸变红,所以能用测定溶液pH值、湿润的蓝色石蕊试液检验,而加入Ba(OH)2溶液、HCl溶液、品红溶液都不能说明溶液呈酸性,故选ae;
故答案为:ae;
(5)Na2S2O5中S元素的化合价为+4价,因此会被氧化为为+6价,即晶体在空气中易被氧化为Na2SO4,用盐酸、氯化钡溶液检验样品中是否含有硫酸根即可,实验方案为:取少量Na2S2O5晶体于试管中,加入适量水溶解,滴加盐酸,振荡,再滴加氯化钡溶液,有白色沉淀生成,
故答案为:取少量Na2S2O5晶体于试管中,加入适量水溶解,滴加盐酸,振荡,再滴加氯化钡溶液,有白色沉淀生成;
(6)①令100mL葡萄酒中二氧化硫的质量为mg,则:
SO2+2H2O+I2═H2SO4+2HI
64g 1mol
mg 0.025L×0.01mol/L
所以,64g:mg=1mol:0.025L×0.01mol/L,
解得m=0.016
故该次实验测得样品中抗氧化剂的残留量(以游离SO2计算)为$\frac{0.016g}{0.1L}$=0.16 g/L
故答案为:0.16;
②若有部分HI被空气氧化,则消耗碘的量偏小,故测定二氧化硫的量偏小,则测定结果偏低,
故答案为:偏低.
点评 本题考查物质的制备实验、实验方案设计、物质含量的测定、氧化还原反应滴定等,难度中等,明确实验原理是解本题关键,根据物质的性质分析解答,注意元素化合物知识的积累和灵活运用.

| A. | 1mol羟基中电子数为10NA | |
| B. | 常温下,1L 0.1mol/L的NH4NO3的溶液中氮原子数为0.2NA | |
| C. | 在反应KIO3+6HI=KI+3 I2+3 H2O中,每生成3mol I2转移的电子数为6NA | |
| D. | 常温常压下,22.4L乙烯中C-H键数为4NA |
Ⅰ、海水中制得的氯化钠除食用外,还用作工业原料,例如通常以NaCI、CO2和NH3为原料制取纯碱,请写出第一步制取NaHCO3的化学方程式:NH3+CO2+H2O+NaCl═NaHCO3↓+NH4Cl.
Ⅱ、工业上以浓缩海水为原料提取溴的部分流程如图1:
已知:Br2常温下呈液态,易挥发,有毒:2Br2+3CO32-=5Br-+BrO3-+3CO2.
(1)通过步骤①氯气氧化已获得含Br2的溶液,为何还需经过吹出、吸收、酸化来重新获得含Br2的溶液,原因是富集溴,提高Br2的浓度.
(2)反应釜2中发生反应的离子方程式为5Br-+BrO3-+6H+=3Br2+3H2O.
(3)向蒸馏塔中通入水蒸气加热,控制温度在90℃左右进行蒸馏的原因是温度过低难以将Br2蒸发出来,但温度过高又会将大量的水蒸馏出来.
Ⅲ、盐卤蒸发冷却后析出卤块的主要成分是MgCI2,此外还含有Fe2+、Fe3+、Mn2+等离子.以卤块为原料制得镁的工艺流程如图2(部分操作和条件已略去):
生成氢氧化物沉淀的pH
| 物质 | 开始沉淀 | 沉淀完全 |
| Fe(OH)3 | 2.7 | 3.7 |
| Fe(OH)2 | 7.6 | 9.6 |
| Mn(OH)2 | 8.3 | 9.8 |
| Mg(OH)2 | 9.6 | 11.1 |
(2)步骤③需在HCI保护气中加热进行,请用化学平衡移动原理解释原因Mg2++2H2O
 Mg(OH)2+2H+,温度升高,水解程度增大,通入HCl,增加c(H+),使平衡逆向移动,抑制Mg2+水解.HCl还能带出水份,最终得到无水MgCl2.
Mg(OH)2+2H+,温度升高,水解程度增大,通入HCl,增加c(H+),使平衡逆向移动,抑制Mg2+水解.HCl还能带出水份,最终得到无水MgCl2.(3)NaCIO还能除去盐卤中的CO(NH2)2,生成盐和能参与大气循环的物质,除去0.1molCO(NH2)2时消耗NaCIO22.35g.

| A. | 金属钠加入无水乙醇中:Na+C2H5OH→C2H5ONa+H2↑ | |
| B. | 过量的乙酸跟Na2CO3溶液反应:2H++CO32-═H2O+CO2↑ | |
| C. | 溴乙烷在NaOH水溶液中加热:CH3CH2Br+NaOH→CH2═CH2↑+NaBr+H2O | |
| D. | 苯酚钠溶液中通入CO2: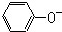 +CO2+H2O→ +CO2+H2O→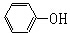 +HCO${\;}_{3}^{-}$ +HCO${\;}_{3}^{-}$ |
| A. | KI的酸性溶液长期置于空气中:4I-+4H++O2═2I2+2H2O | |
| B. | 高锰酸钾酸性溶液与草酸溶液反应:2MnO4-+5C2O42-+16H+═2Mn2++10CO2↑+8H2O | |
| C. | 用稀硫酸除去铁片表面的铁锈:Fe2O3+6H+═2Fe3++3H2O | |
| D. | 硫代硫酸钠溶液中滴加稀硫酸:2H++S2O32-═S↓+SO2↑+H2O |
 如图是一种形状酷似一条小狗的有机物.化学家Tim Rickard将其取名为“doggycene”.doggycene的分子式为C26H26.该分子中所有碳原子可能(填“可能”或“不可能”)处予同一平面.
如图是一种形状酷似一条小狗的有机物.化学家Tim Rickard将其取名为“doggycene”.doggycene的分子式为C26H26.该分子中所有碳原子可能(填“可能”或“不可能”)处予同一平面.
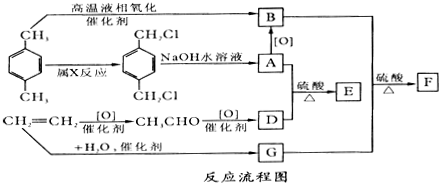
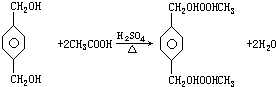 ;B+G→F
;B+G→F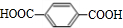 +CH3CH2OH$→_{△}^{浓H_{2}SO_{4}}$
+CH3CH2OH$→_{△}^{浓H_{2}SO_{4}}$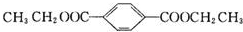 .
.