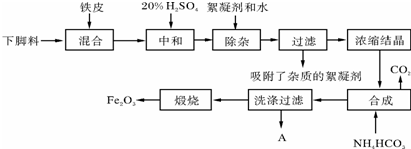
题目内容
19.将标准状况下密度为ρ的a L HCl(g)溶于1000g水中,得到盐酸的密度为b g/cm3,则该盐酸的物质的量浓度是( )| A. | $\frac{ρ}{22.4}$ mol/L | B. | $\frac{ab}{22400}$ mol/L | ||
| C. | $\frac{ab}{22400+36.5a}$ mol/L | D. | $\frac{1000ab}{22400+36.5a}$ mol/L |
分析 根据n=$\frac{V}{{V}_{m}}$计算出aL标准状况下氯化氢的物质的量,再根据m=nM计算出氯化氢的质量,从而得出所得溶液的质量,然后根据V=$\frac{m}{ρ}$计算出所得溶液体积,最后根据c=$\frac{n}{V}$计算出该盐酸的物质的量浓度.
解答 解:aL标准状况下的HCl的物质的量为:$\frac{aL}{22.4L/mol}$=$\frac{a}{22.4}$mol,质量为:36.5g/mol×$\frac{a}{22.4}$mol=$\frac{36.5a}{22.4}$g,
$\frac{a}{22.4}$mol氯化氢气体溶于1000g水中,所得溶液的质量为:1000g+$\frac{36.5a}{22.4}$g,所得溶液的体积为:$\frac{1000g+\frac{36.5a}{22.4}g}{bg/c{m}^{3}}$=$\frac{22400+36.5a}{22.4b}$×10-3L,
所有该盐酸的物质的量浓度为:c=$\frac{\frac{a}{22.4}mol}{\frac{22400+36.5a}{22.4b}×1{0}^{-3}L}$=$\frac{1000ab}{22400+36.5a}$mol/L,
故选D.
点评 本题考查了物质的量浓度的计算,题目难度中等,明确物质的量浓度的概念及表达式为解答关键,注意熟练掌握物质的量与摩尔质量、物质的量浓度、气体摩尔体积等物理量之间的关系.

练习册系列答案
相关题目
9.某温度下气体反应达到化学平衡,平衡常数K=$\frac{c(A)•c2(B)}{c2(E)•c(F)}$,恒容时,若温度适当降低,F的浓度增加.下列说法中正确的是( )
| A. | 增大c(A)、c(B),K增大 | |
| B. | 降低温度,正反应速率增大 | |
| C. | 该反应的焓变为负值 | |
| D. | 该反应的化学方程式为2E(g)+F(g)?A(g)+2B(g) |
10.根据理论研究,元素周期表可容纳164种元素.理论上164号、114号、14号元素位于同一主族.根据你所学知识,下列有关预测肯定不正确的是( )
| A. | 164号元素是金属元素 | |
| B. | 164号元素位于ⅣA族 | |
| C. | 164号元素对应的最高价氧化物的水化物其碱性比114号的强 | |
| D. | 164号元素存在稳定的气态氢化物,且还原性比SiH4弱 |
7.装置图所示,有关分析不正确的是( )
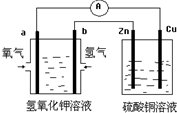

| A. | 该装置中Cu极为阳极 | |
| B. | 工作时,左池中K+移向a电极 | |
| C. | 工作一段时间,要使右池溶液复原可加入适量的CuO | |
| D. | b极的电极反应式:H2+2OH--2e-═2H2O |
14.设NA 为阿伏伽德罗常数的值,下列叙述正确的是( )
| A. | 1mol羟基中电子数为10NA | |
| B. | 常温下,1L 0.1mol/L的NH4NO3的溶液中氮原子数为0.2NA | |
| C. | 在反应KIO3+6HI=KI+3 I2+3 H2O中,每生成3mol I2转移的电子数为6NA | |
| D. | 常温常压下,22.4L乙烯中C-H键数为4NA |
19.海洋约占地球表面积的71%,具有十分巨大的开发潜力,通过海水的综合利用可获得许多物质供人类使用.
Ⅰ、海水中制得的氯化钠除食用外,还用作工业原料,例如通常以NaCI、CO2和NH3为原料制取纯碱,请写出第一步制取NaHCO3的化学方程式:NH3+CO2+H2O+NaCl═NaHCO3↓+NH4Cl.
Ⅱ、工业上以浓缩海水为原料提取溴的部分流程如图1:
已知:Br2常温下呈液态,易挥发,有毒:2Br2+3CO32-=5Br-+BrO3-+3CO2.
(1)通过步骤①氯气氧化已获得含Br2的溶液,为何还需经过吹出、吸收、酸化来重新获得含Br2的溶液,原因是富集溴,提高Br2的浓度.
(2)反应釜2中发生反应的离子方程式为5Br-+BrO3-+6H+=3Br2+3H2O.
(3)向蒸馏塔中通入水蒸气加热,控制温度在90℃左右进行蒸馏的原因是温度过低难以将Br2蒸发出来,但温度过高又会将大量的水蒸馏出来.
Ⅲ、盐卤蒸发冷却后析出卤块的主要成分是MgCI2,此外还含有Fe2+、Fe3+、Mn2+等离子.以卤块为原料制得镁的工艺流程如图2(部分操作和条件已略去):
生成氢氧化物沉淀的pH
(1)用NaCIO氧化Fe2+得到Fe(OH)3沉淀的离子反应方程式是ClO-+2Fe2++5H2O=2Fe(OH)3+Cl-+4H+.
(2)步骤③需在HCI保护气中加热进行,请用化学平衡移动原理解释原因Mg2++2H2O Mg(OH)2+2H+,温度升高,水解程度增大,通入HCl,增加c(H+),使平衡逆向移动,抑制Mg2+水解.HCl还能带出水份,最终得到无水MgCl2.
Mg(OH)2+2H+,温度升高,水解程度增大,通入HCl,增加c(H+),使平衡逆向移动,抑制Mg2+水解.HCl还能带出水份,最终得到无水MgCl2.
(3)NaCIO还能除去盐卤中的CO(NH2)2,生成盐和能参与大气循环的物质,除去0.1molCO(NH2)2时消耗NaCIO22.35g.

Ⅰ、海水中制得的氯化钠除食用外,还用作工业原料,例如通常以NaCI、CO2和NH3为原料制取纯碱,请写出第一步制取NaHCO3的化学方程式:NH3+CO2+H2O+NaCl═NaHCO3↓+NH4Cl.
Ⅱ、工业上以浓缩海水为原料提取溴的部分流程如图1:
已知:Br2常温下呈液态,易挥发,有毒:2Br2+3CO32-=5Br-+BrO3-+3CO2.
(1)通过步骤①氯气氧化已获得含Br2的溶液,为何还需经过吹出、吸收、酸化来重新获得含Br2的溶液,原因是富集溴,提高Br2的浓度.
(2)反应釜2中发生反应的离子方程式为5Br-+BrO3-+6H+=3Br2+3H2O.
(3)向蒸馏塔中通入水蒸气加热,控制温度在90℃左右进行蒸馏的原因是温度过低难以将Br2蒸发出来,但温度过高又会将大量的水蒸馏出来.
Ⅲ、盐卤蒸发冷却后析出卤块的主要成分是MgCI2,此外还含有Fe2+、Fe3+、Mn2+等离子.以卤块为原料制得镁的工艺流程如图2(部分操作和条件已略去):
生成氢氧化物沉淀的pH
| 物质 | 开始沉淀 | 沉淀完全 |
| Fe(OH)3 | 2.7 | 3.7 |
| Fe(OH)2 | 7.6 | 9.6 |
| Mn(OH)2 | 8.3 | 9.8 |
| Mg(OH)2 | 9.6 | 11.1 |
(2)步骤③需在HCI保护气中加热进行,请用化学平衡移动原理解释原因Mg2++2H2O
 Mg(OH)2+2H+,温度升高,水解程度增大,通入HCl,增加c(H+),使平衡逆向移动,抑制Mg2+水解.HCl还能带出水份,最终得到无水MgCl2.
Mg(OH)2+2H+,温度升高,水解程度增大,通入HCl,增加c(H+),使平衡逆向移动,抑制Mg2+水解.HCl还能带出水份,最终得到无水MgCl2.(3)NaCIO还能除去盐卤中的CO(NH2)2,生成盐和能参与大气循环的物质,除去0.1molCO(NH2)2时消耗NaCIO22.35g.

20.某自来水中含有Ca2+、Mg2+、Na+、K+、HCO3-、SO42-、Cl-,长期烧煮上述自来水会在锅炉内形成水垢,锅炉水垢不仅耗费燃料,而且有烧坏锅炉的危险,因此要定期清除锅炉水垢,已知部分物质20℃时的溶解度数据有:
(1)请用化学方程式表示锅炉中的水垢含有Mg(OH)2的原因:Mg(HCO3)2$\frac{\underline{\;\;△\;\;}}{\;}$MgCO3↓+H2O+CO2↑、MgCO3+H2O$\frac{\underline{\;\;△\;\;}}{\;}$Mg(OH)2+CO2↑.
(2)锅炉中的水垢所含有的CaSO4不能直接用酸除去,需要加入试剂X使其转化为易溶于盐酸的物质Y而除去,试剂X是C(填序号).
A.食醋 B.氯化钡 C.碳酸钠 D.碳酸氢钠
CaSO4能转化为物质Y的原因是(用文字叙述)碳酸钙的溶解度小于硫酸钙的溶解度.
(3)除含CaSO4、Mg(OH)2外,锅炉水垢中还可能含有的物质是(写化学式)CaCO3、MgCO3等.
(4)水中的Ca2+、Mg2+可以用一定浓度的M溶液进行测定,M与Ca2+、Mg2+都以等物质的量进行反应,现取含Ca2+浓度为0.40g/L的自来水样10mL至锥形瓶中进行滴定,达到终点时,用去了浓度为0.01mol/L的M溶液20.00mL,则该自来水样中Mg2+的物质的量浓度是0.01 mol/L.
| 物质 | Mg(OH)2 | CaCO3 | MgCO3 | Ca(OH)2 | CaSO4 | MgSO4 |
| 溶解度(g/100g H2O) | 9.0×10-4 | 1.5×10-3 | 1.0×10-2 | 1.7×10-1 | 2.0×10-1 | 26.7 |
(2)锅炉中的水垢所含有的CaSO4不能直接用酸除去,需要加入试剂X使其转化为易溶于盐酸的物质Y而除去,试剂X是C(填序号).
A.食醋 B.氯化钡 C.碳酸钠 D.碳酸氢钠
CaSO4能转化为物质Y的原因是(用文字叙述)碳酸钙的溶解度小于硫酸钙的溶解度.
(3)除含CaSO4、Mg(OH)2外,锅炉水垢中还可能含有的物质是(写化学式)CaCO3、MgCO3等.
(4)水中的Ca2+、Mg2+可以用一定浓度的M溶液进行测定,M与Ca2+、Mg2+都以等物质的量进行反应,现取含Ca2+浓度为0.40g/L的自来水样10mL至锥形瓶中进行滴定,达到终点时,用去了浓度为0.01mol/L的M溶液20.00mL,则该自来水样中Mg2+的物质的量浓度是0.01 mol/L.