题目内容
【题目】(1)氯酸是一种强酸,氯酸的浓度超过40%就会迅速分解,反应的化学方程式为8HClO3=3O2↑+2Cl2↑+4HClO4+2H2O。根据题意完成下列小题:
①在上述变化过程中,发生还原反应的过程是_____→____(填化学式)。
②该反应的氧化产物是________(填化学式)。
(2)已知测定锰的一种方法是:锰离子转化为高锰酸根离子,反应体系中有H+、Mn2+、H2O、IO3-、MnO4-、IO4-。有关反应的离子方程式为_____。
(3)工业尾气中含有大量的氮氧化物,NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术。反应原理如图所示:
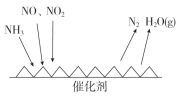
①由上图可知SCR技术中的氧化剂为_____________。
②用Fe作催化剂加热时,在氨气足量的情况下,当NO2与NO的物质的量之比为1∶1时,写出该反应的化学方程式:________。
【答案】HClO3 Cl2 O2 HClO4 2Mn2++5 IO4+3H2O=2MnO4+5 IO3+6H+ 2NH3+NO+NO2![]() 2N2+3H2O
2N2+3H2O
【解析】
(1)得电子的反应物是氧化剂,氧化剂在反应中发生还原反应,失电子的反应物是还原剂,还原剂对应的产物是氧化产物;
(2)锰离子失电子而转化为高锰酸根离子,所以锰离子作还原剂,则得电子化合价降低的物质作氧化剂,根据元素的化合价确定氧化剂和还原产物,再结合离子方程式的书写规则书写;
(3)①得电子,化合价降低的反应物是氧化剂;
②根据化合价升降总数相等、原子守恒来配平;
(1)①8HClO3=3O2↑+2Cl2↑+4HClO4+2H2O中,氧化剂和还原剂都是HClO3,HClO3中Cl元素得电子化合价降低生成Cl2而发生还原反应,所以发生还原反应的过程是HClO3→Cl2;
故答案为:HClO3;Cl2;
②O氧元素的化合价由2价→0价,Cl元素的化合价由+5价→+7价,所以氧化产物是O2、HClO4;
故答案为:O2、HClO4;
(2)①锰离子失电子被氧化生成高锰酸根离子,所以锰离子作还原剂,氧化剂得电子化合价降低,IO3和IO4中碘元素的化合价分别是+5价和+7价,所以IO4作氧化剂,还原产物是IO3,同时水参加反应生成氢离子,所以该反应的离子方程式为:2Mn2++5 IO4+3H2O=2MnO4+5 IO3+6H+,
故答案为:2Mn2++5 IO4+3H2O=2MnO4+5 IO3+6H+;
(3)①由图甲可知SCR技术中NH3与NO、NO2反应产物为N2和水,故氧化剂为NO、NO2,
故答案为:NO、NO2;
②NH3中氮的化合价由-3价升高到0价,一个NH3失去3个电子,NO2中氮的化合价由+4价降低到0价,一个NO2得到4个电子,NO中氮的化合价由+2价降低到0价,一个NO得到2个电子,当NO2与NO的物质的量之比为1:1时,转移电子的最小公倍数为6,结合质量守恒可知方程式为:2NH3+NO+NO2![]() 2N2+3H2O,
2N2+3H2O,
故答案为:2NH3+NO+NO2![]() 2N2+3H2O;
2N2+3H2O;

 阳光课堂课时优化作业系列答案
阳光课堂课时优化作业系列答案【题目】如图是元素周期表的一部分,表中列出了①~⑧元素。
IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 | |
二 | ① | ② | ||||||
三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
用元素符号或化学式填写下列空格:
(1)①~⑦元素中,原子半径最大的元素是_______(填元素符号),最高价氧化物对应水化物中酸性最强的物质是____________________(填酸的化学式)。
(2)①的气态氢化物的电子式为_________________。
(3)①~⑧元素中,③的氢氧化物的碱性______④的氢氧化物(“大于、小于或等于”);②的氢化物稳定性______⑦的氢化物(“大于、小于或等于”)。
【题目】下列离子方程式不能用来解释相应实验现象的是
选项 | 实验现象 | 离子方程式 |
A | 向氢氧化镁悬浊液中滴加氯化铵溶液,沉淀溶解 | Mg(OH)2+2NH4+ |
B | 向酸性KMnO4溶液中滴加草酸钠溶液,紫色溶液褪色 | 2MnO4-+5C2O42-+8H2O=2Mn2++10CO2↑+16OH- |
C | 将二氧化硫通入足量的Ba(NO3)2溶液中,产生白色沉淀和无色气体(遇空气变红棕色) | 3SO2+3Ba2++2NO3-+2H2O=3BaSO4↓+2NO↑+4H+ |
D | 氢氧化铁溶于HI溶液中 | 2Fe(OH)3+6H++2I-=2Fe2++I2+6H2O |
A.AB.BC.CD.D