题目内容
【题目】工业上乙醚可用于制造无烟火药。实验室合成乙醚的原理如下:
主反应 2CH3CH2OH![]() CH3CH2OCH2CH3+H2O
CH3CH2OCH2CH3+H2O
副反应CH3CH2OH![]() CH2=CH2↑+H2O
CH2=CH2↑+H2O
(乙醚的制备)
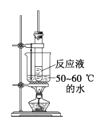
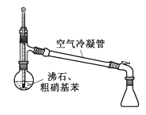
实验装置如图所示(夹持装置和加热装置略)

(1)仪器a是_____(写名称);仪器b应更换为下列的 ___(填字母)。
A.干燥器
B.直形冷凝管
C.玻璃管
D.安全瓶
(2)实验操作的正确排序为_____(填字母),取出乙醚后立即密闭保存。
a.组装实验仪器
b.加入12mL浓硫酸和少量乙醇的混合物
c.检查装置气密性
d.熄灭酒精灯
e.点燃酒精灯
f.通冷却水
g.控制滴加乙醇的速率与产物馏出的速率相等
h.弃去前馏分
i.拆除装置
(3)加热后发现仪器a中没有添加碎瓷片,处理方法是_____;若滴入乙醇的速率显著超过产物馏出的速率,则反应速率会降低,可能的原因是 ____。
(乙醚的提纯)
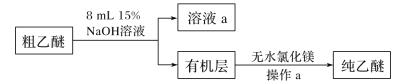
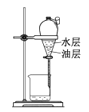
(4)用15%NaOH溶液洗涤粗乙醚的原因是____________;无水氯化镁的作用是_____。
(5)操作a的名称是____;进行该操作时,必须用水浴代替酒精灯加热,其目的与制备实验中将尾接管支管接室外相同,均为____。
【答案】三颈烧瓶 B acbfeghdi 先停止加热,待烧瓶中的溶液冷却至室温,再重新加入碎瓷片 滴入乙醇的速率过快,溶液温度骤降,导致反应速率降低 除去挥发出来的乙醇 干燥乙醚 蒸馏 避免乙醚蒸气爆炸
【解析】
装置a为三颈烧瓶,是有机制备中常见的反应器皿,一孔放温度计,一孔接分液漏斗滴加原料,另一孔导出产物,b为球形冷凝管,使产物乙醚冷凝,经牛角管(尾接管)进入圆底烧瓶中,结合资料可以发现乙醚沸点较低,因此要用冰水浴,减少乙醚挥发,据此来分析作答即可。
(1)仪器a有三个“脖子”,因此为三颈烧瓶,仪器b是球形冷凝管,应改用直形冷凝管,答案选B;
(2)实验操作顺序:按照先左后右,先下后上的顺序组装好仪器,然后检查装置的气密性,加入反应物,为防止冷凝管受热后遇冷破裂同时保证冷凝效果,先通冷却水后加热烧瓶;实验过程中控制滴加乙醇的速率与产物馏出的速率相等;实验结束时操作顺序与开始时相反,即遵循“先开后关,后开先关”的原则,答案为acbfeghdi;
(3)加热后发现仪器a中没有添加碎瓷片,不能直接补加,应先停止加热,待烧瓶中的溶液冷却至室温,再重新加入碎瓷片;若滴入乙醇的速率过快,溶液温度骤降,导致反应速率降低(其它合理答案也可);
(4)粗乙醚中混杂着挥发出的乙醇,乙醇与水互溶,因此可以用![]() 溶液来洗涤除去乙醇,而无水氯化镁是一种常见的干燥剂,可以用来干燥乙醚;
溶液来洗涤除去乙醇,而无水氯化镁是一种常见的干燥剂,可以用来干燥乙醚;
(5)操作a是蒸馏,将乙醚和氯化镁分离;乙醚在空气中遇热易爆炸,因此不能使用明火加热,只能使用水浴加热;而尾接管接室外也是为了防止室内乙醚蒸气浓度过大导致爆炸。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
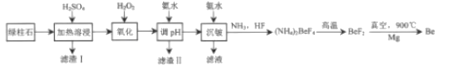
小学生10分钟应用题系列答案【题目】工业上常用绿柱石(主要成分3BeOAl2O36SiO2,还含有铁元素)冶炼铍,其简化的工艺流程如图所示:
已知:Be和Al性质相似:几种金属阳离子的氢氧化物沉淀时的pH如表:
Be2+ | Al3+ | Fe3+ | Fe2+ | |
开始沉淀时 | 5.2 | 3.3 | 1.5 | 6.5 |
沉淀完全时 | 8.8 | 5.0 | 3.7 | 9.7 |
回答下列问题:
(1)滤渣Ⅰ的主要成分是______,加入H2O2的作用是______。
(2)得到滤渣Ⅱ的合理pH范围是______。
(3)用化学方程式解释不宜使用NaOH溶液来沉铍的原因是______。
(4)得到(NH4)2BeF4的化学方程式为______。
(5)由Mg还原BeF2得到Be需要真空的环境,其原因是______。
(6)若绿柱石中BeO的含量为a%,1吨绿柱石能生产含铍2%的合金b吨,则Be的利用率为______。(用含a、b的表达式表示)