题目内容
【题目】明矾[KAI(SO4)212H2O]是一种重要的化工产品,在生产、生活中都有广泛的用途。
某工厂计划利用炼铝厂的废料铝灰(含Al、A12O3、少量SiO2和FeOxFe2O3)为原料生产明矾产品,设计的生产工艺流程如下:
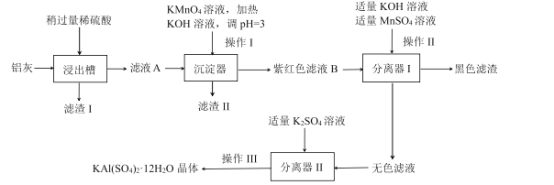
己知:![]()
请回答下列问题:
(1)检验滤液A中是否存在Fe2+,可用K3[Fe(CN)6]溶液,请写出其检验的离子反应方程式____。
(2)沉淀器中加入KMnO4溶液的作用是____;有人认为该生产流程较为复杂,可以用____溶液(填化学式)代替KMnO4溶液而使操作Ⅰ和操作Ⅱ过程得到优化。
(3)操作Ⅲ是 ___、____(填操作名称)、过滤、洗涤;在洗涤晶体时采用的洗涤剂最合适的是 ___(填正确答案标号)。
A.稀硫酸 B.蒸馏水 C.70%酒精
(4)明矾可作净水剂,其净水原理是 ____用离子方程式表示)。
(5)在沉淀器中调pH=3,请计算说明Fe3+是否完全沉淀(当Fe3+离子浓度小于或等于1.0x 10-5 mol/L时,可以认为溶液中无该离子)____。
【答案】2Fe(CN)63- +3Fe2+= Fe3[Fe(CN)6]2↓ 氧化Fe2+为Fe3+ H2O2 蒸发浓缩 冷却结晶 C Al3++3H2O![]() Al(OH)3(胶体)+3H+ 由
Al(OH)3(胶体)+3H+ 由![]() 可知,
可知,![]() ,所以Fe3+没有沉淀完全。
,所以Fe3+没有沉淀完全。
【解析】
铝灰含Al、A12O3、少量SiO2和FeOxFe2O3,加稀硫酸,得到滤渣∣为SiO2,滤液中含有Al3+、Fe2+、Fe3+,加入KMnO4溶液,氧化
Fe2+为Fe3+,加KOH溶液调节pH,将Fe3+反应生成Fe(OH)3的红褐色沉淀除去,所以滤渣Ⅱ为Fe(OH)3沉淀,紫红色溶液B中含MnO4-,加入MnSO4,发生歧化反应,生成MnO2的黑色固体,得到无色溶液中主要含有Al3+,加入K2SO4,生成明矾[KAI(SO4)212H2O]晶体。
(1)Fe2+与K3[Fe(CN)6]溶液反应生成Fe3[Fe(CN)6]2的蓝色沉淀,其离子反应方程式为:2Fe(CN)63- +3Fe2+= Fe3[Fe(CN)6]2↓,故答案为:2Fe(CN)63- +3Fe2+= Fe3[Fe(CN)6]2↓。
(2)KMnO4溶液具有强氧化性,氧化Fe2+为Fe3+,过氧化氢也具有强氧化性,也能将Fe2+氧化为Fe3+,可以用H2O2溶液代替KMnO4溶液,故答案为:氧化Fe2+为Fe3+;H2O2。
(3)得到明矾[KAI(SO4)212H2O]晶体,蒸发浓缩、冷却结晶、过滤、洗涤;[KAI(SO4)212H2O]易溶于水,也与稀硫酸反应,所以用70%的酒精洗涤晶体,故答案为:蒸发浓缩;冷却结晶;C。
明矾可作净水剂,[KAI(SO4)212H2O]中Al3+水解生成氢氧化铝的胶体,吸附水中悬浮的颗粒,其离子反应方程式为:Al3++3H2O![]()
Al(OH)3(胶体)+3H+,故答案为:Al3++3H2O![]() Al(OH)3(胶体)+3H+;
Al(OH)3(胶体)+3H+;
(5)pH=3,![]() ,由
,由![]() 可知,
可知,![]() ,所以Fe3+没有沉淀完全,故答案为:由
,所以Fe3+没有沉淀完全,故答案为:由![]() 可知,
可知,![]() ,所以Fe3+没有沉淀完全。
,所以Fe3+没有沉淀完全。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】氧化铝陶瓷常用于厚膜集成电路,制备氧化铝陶瓷的合成路线如图所示,回答下列问题。
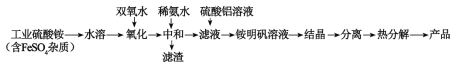
(1)“氧化”步骤发生的离子方程式为:___,使用双氧水作氧化剂优点为___:
(2)“热分解”得到的产物除了氧化铝外,还有NH3、N2、SO2、SO3、H2O生成,则氧化产物和还原产物的物质的量之比为___。
(3)铵明矾晶体的化学式为NH4Al(SO4)2·12H2O,“热分解”步骤中,其各温度段内受热“失重计算值”(失重计算值%=![]() ×100%)如表所示:
×100%)如表所示:
温度区间(℃) | 18→190 | 190→430 | 430→505 | 505→900 |
失重计算值(%) | 39.20 | 7.80 | 13.00 | 26.00 |
通过上述数据经粗略计算可判断,在温度区间___铵明矾基本上失去了全部结晶水。
(4)“结晶”步骤中常采用的操作是___。
(5)合成过程中常使用过量的工业硫酸铵,可利用硫酸铵溶液水解显酸性抑制硫酸铝水解,另外的一个重要作用是___。
(6)通常认为金属离子浓度等于1×10-5mol/L即可认为沉淀完全,试计算常温下“中和”步骤中需要调节溶液pH=___(保留一位小数,已知:Ksp[Fe(OH)3]=8.0×10-38,lg5=0.7)。