题目内容
13. 汽车尾气治理的方法之一是在汽车的排气管上安装一个“催化转化器”.
汽车尾气治理的方法之一是在汽车的排气管上安装一个“催化转化器”.已知反应2NO(g)+2CO(g)?N2(g)+2CO2(g)△H=-113kJ•mol-1
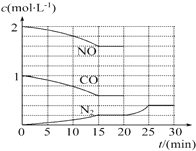
①为了模拟催化转化器的工作原理,在T℃时,将2mol NO与1mol CO充入1L反应容器中,反应过程中NO(g)、CO(g)、N2(g)的物质的量浓度变化如下图所示,则反应进行到15min时,NO的平均反应速率为0.027mol•L-1•min-1.
②请在图中画出20~30min内NO、CO浓度发生变化的曲线,引起该变化的条件可能是b(填字母).
a.加入催化剂 b.降低温度
c.缩小容器体积 d.增加CO2的物质的量
③当25min达到平衡后,若保持体系温度、容积不变,再向容器中充入NO、N2气体各1mol,平衡将向左移动(填“向左”“向右”或“不”).
(3)用CH4催化还原NOx也可以消除氮氧化物的污染.例如,
CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H=-574kJ•mol-1
CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H=-1 160kJ•mol-1
若用标准状况下4.48L CH4还原NO2至N2,则整个过程中共放出热量173.4kJ.
分析 ①根据V=$\frac{\frac{△n}{V}}{△t}$来计算;
②根据氮气的变化来确定NO、CO的变化;结合图象根据外界条件对化学平衡的影响来判断;
③先根据三段法求出各自的浓度,然后求出平衡常数和浓度熵,最后根据平衡常数的大小与浓度熵的大小来确定平衡移动方向;
(3)知①CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H=-574kJ•mol-1,②CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H=-1 160kJ•mol-1,
利用盖斯定律将$\frac{①+②}{2}$可得CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(g),根据盖斯定律计算反应的焓变,结合热化学方程式进行计算.
解答 解:①由图象可知在15min内NO的物质的量变化0.4mol,则NO的平均反应速率为=$\frac{\frac{0.4}{1}}{15}$mol•L-1•min-1=0.027 mol•L-1•min-1,故答案为:0.027 mol•L-1•min-1;
②氮气的变化的物质的量与NO、CO的变化的物质的量成正比,25分钟后达到平衡,图象为: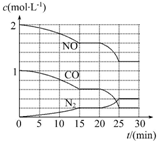
由图象可知,平衡向正反应方向移动,
a、加入催化剂,平衡不移动,故a错误;
b、降低温度,平衡向正反应方向移动,故b正确;
c、缩小容器体积,平衡向正反应方向移动,达平衡时,浓度应大于25min时的浓度,故c错误;
d、增加CO2的物质的量,平衡向逆反应方向移动,氮气的平衡浓度降低,故d错误.
故答案为: ;b;
;b;
③化学平衡常数等于平衡时生成物的浓度幂之积比上反应物浓度幂之积,所以K=$\frac{{c}^{2}(C{O}_{2})•c({N}_{2})}{{c}^{2}(NO)•{c}^{2}(CO)}$,由平衡常数表达式可知一氧化氮的系数是2次方,所以再向容器中充入NO、N2气体各1mol,分母增加的幅度大,导致QC减小,即平衡逆向移动,即向左移动,故答案为:向左;
(3)已知①CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H=-574kJ•mol-1,②CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H=-1 160kJ•mol-1,
利用盖斯定律将$\frac{①+②}{2}$可得CH4(g)+2NO2(g)═N2(g)+CO2(g)+2H2O(g),△H=-$\frac{574+1160}{2}$kJ•mol-1=-867kJ•mol-1,若用标准状况下4.48L即0.2mol CH4还原NO2至N2,则整个过程中共放出热量867kJ×0.2=173.4kJ,故答案为:173.4.
点评 本题主要考查了平衡常数的计算、外界条件对平衡的影响、盖斯定律的应用等知识,难度中等,注意知识的归纳和梳理是关键.

| A. | 二氧化碳气体通入无色酚酞溶液,溶液变红色 | |
| B. | 细铁丝在氧气里剧烈燃烧,火星四射 | |
| C. | 点燃棉线闻到一股烧焦的羽毛味 | |
| D. | 打开浓盐酸试剂瓶的瓶塞,瓶口上方出现大量白烟 |
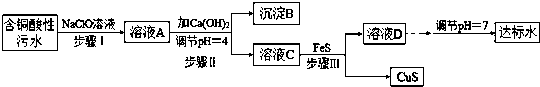
相关信息:
①含铜酸性污水主要污染物离子(见表-1)
表-1
| 离子 | H+ | Cu2+ | Fe3+ | Fe2+ |
| 浓度/(mol/L) | 0.1 | 0.05 | 0.04 | 0.002 |
③FeS能溶于pH<4的酸性溶液.
④25℃时,某些难溶电解质的溶度积(Ksp) (见表-2)
表-2
| 物质 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | FeS | CuS |
| Kw | 4.0×10-38 | 8.0×10-16 | 2.2×10-20 | 6.4×10-13 | 6.0×10-36 |
(1)该含铜酸性污水的pH=1.
(2)步骤Ⅰ中所发生的主要反应的离子方程式为2Fe2++ClO-+2H+=2Fe3++Cl-+H2O.
(3)步骤II中,调节溶液的pH=4的目的为使沉淀完全,防止沉淀,防止FeS溶解.
(4)有人认为,步骤II中只需加入Ca(OH)2调节溶液的pH=7,即可将污水处理成符合标准的达标水,该观点不合理(填“合理”或“不合理”),试通过简单计算说明理由pH=7时溶液中c(Cu2+)=2.2×10-20÷(10-7)2=2.2×10-6mol•L-1,大于国家规定的排放标准c(Cu2+)≤1.0×10-7mol•L-1.
(5)步骤III中所发生的主要反应的离子方程式为Cu2++FeS=CuS+Fe2+;该过程不选用易溶的Na2S作沉淀剂,其原因可能为Na2S价格高且引入过多杂质离子.
(6)上述整个处理工艺中,可以回收的金属化合物有Fe(OH)3、CuS(填化学式).
| A. | 18g重水(D2O)中含有10NA个电子 | |
| B. | 22.4L一氯甲烷的分子数约为NA | |
| C. | 4.6g Na在氧气中完全反应生成Na2O和Na2O2,转移电子数为0.2NA | |
| D. | 25℃时,1L pH=14的Ba(OH)2溶液中,Ba2+数目为NA |
| A. | 气态氢化物的稳定性:Y>X>W | |
| B. | 四种元素的原子中W原子半径最大 | |
| C. | 四种元素中最高价氧化物的水化物酸性Y最强 | |
| D. | 化合物XY2与ZY2分子中的化学键类型相同 |
| A. | 把SO2通入酸性高锰酸钾溶液,即可验证SO2的漂白性 | |
| B. | 无论是在0.1mol•L-1的CH3COOH溶液中加水稀释,还是加入少量CH3COONa晶体,都会引起溶液的导电能力减弱 | |
| C. | 实验室需用480mL 0.1mol•L-1硫酸铜溶液,应称取12.5g胆矾晶体,并用500mL容量瓶定容配制 | |
| D. | 硫酸亚铁铵晶体中NH4+的检验操作为:取适量样品置于试管中加水溶解,滴加少量稀氢氧化钠溶液,并将湿润的红色石蕊试纸靠近试管口,试纸变蓝则存在NH4+,反之则不存在NH4+ |
 将一定质量的镁、铝合金投入100mL一定物质的量浓度的盐酸中,使合金全部溶解.向所得溶液中滴加5mol/L NaOH溶液至过量,生成沉淀的质量与加入的NaOH溶液体积的关系如图曲线所示.则盐酸的物质的量浓度为( )
将一定质量的镁、铝合金投入100mL一定物质的量浓度的盐酸中,使合金全部溶解.向所得溶液中滴加5mol/L NaOH溶液至过量,生成沉淀的质量与加入的NaOH溶液体积的关系如图曲线所示.则盐酸的物质的量浓度为( )| A. | 1mol/L | B. | 8mol/L | C. | 10mol/L | D. | 12mol/L |
 .
.