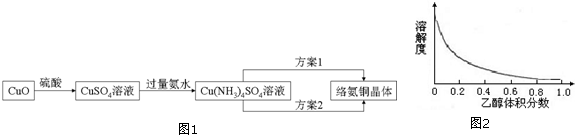
题目内容
18.短周期元素W、X、Y、Z的原子序数依次增大,W的单质是空气中体积分数最大的气体,W与Y原子的最外层电子数之和为X原子的最外层电子数的2倍,Z原子的最外层电子数等于其最内层电子数,X、Y、Z的简单离子的电子层结构相同.下列说法正确的是( )| A. | 气态氢化物的稳定性:Y>X>W | |
| B. | 四种元素的原子中W原子半径最大 | |
| C. | 四种元素中最高价氧化物的水化物酸性Y最强 | |
| D. | 化合物XY2与ZY2分子中的化学键类型相同 |
分析 短周期元素W、X、Y、Z 的原子序数依次增大,W的单质是空气中体积分数最大的气体,则W为N元素;Z最外层电子数等于最内层电子数,原子序数大于N元素,只能处于第三周期,故Z为Mg元素;X、Y、Z的简单离子的电子层结构相同,结构原子序数可知,X只能处于第二周期,且最外层电子数大于5,W(氮元素)与Y最外层电子数之和为X的最外层电子数的2倍,则Y原子最外层电子数只能为奇数,结合原子序数可知,Y不可能处于ⅠA族,只能处于ⅦA族,故Y为F元素,X最外层电子数为$\frac{5+7}{2}$=6,则X为O元素,据此解答.
解答 解:短周期元素W、X、Y、Z 的原子序数依次增大,W的单质是空气中体积分数最大的气体,则W为N元素;Z最外层电子数等于最内层电子数,原子序数大于N元素,只能处于第三周期,故Z为Mg元素;X、Y、Z的简单离子的电子层结构相同,结构原子序数可知,X只能处于第二周期,且最外层电子数大于5,W(氮元素)与Y最外层电子数之和为X的最外层电子数的2倍,则Y原子最外层电子数只能为奇数,结合原子序数可知,Y不可能处于ⅠA族,只能处于ⅦA族,故Y为F元素,X最外层电子数为$\frac{5+7}{2}$=6,则X为O元素.
A.非金属性Y(F)>X(O)>W(N),故氢化物稳定性HF>H2O>NH3,故A正确;
B.同周期随原子序数增大原子半径减小,同主族自上而下原子半径增大,故原子半径r(Mg)>r(N)>r(O)>r(F),故B错误;
C.Y为F元素,没有最高价含氧酸,故C错误;
D.OF2中含有共价键,MgF2中含有离子键,二者化学键类型不同,故D错误,
故选:A.
点评 本题考查结构性质位置关系应用,推断元素是解题关键,注意利用奇偶性判断Y可能所在的族,对学生的逻辑推理有一定的要求,难度中等.

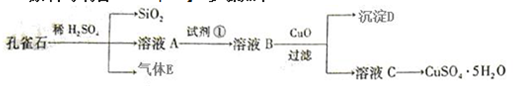
Ⅰ.加入NaOH和Na2CO3混合液,加热,浸泡数小时;
Ⅱ.放出洗涤废液,清水冲洗锅炉,加入稀盐酸,浸泡;
Ⅲ.向洗液中加入Na2SO3溶液;
Ⅳ.清洗达标,用NaNO2溶液钝化锅炉.
(1)用NaOH溶解二氧化硅的化学方程式是SiO2+2NaOH═Na2SiO3+H2O.
(2)已知:20℃时溶解度/g
| CaCO3 | CaSO4 | Mg(OH)2 | MgCO3 |
| 1.4×10-3 | 2.55×10-2 | 9×10-4 | 1.1×10-2 |
(3)在步骤Ⅱ中:
①被除掉的水垢除铁锈外,还有CaCO3、Mg(OH)2、SiO2.
②清洗过程中,溶解的铁锈会加速锅炉腐蚀,用离子方程式解释其原因2Fe3++Fe═3Fe2+.
(4)步骤Ⅲ中,加入Na2SO3的目的是SO32-+2Fe3++H2O=SO42-+2Fe2++2H+,将Fe3+还原成Fe2+,防止Fe3+腐蚀锅炉.(结合离子方程式用文字表达)
(5)步骤Ⅳ中,钝化后的锅炉表面会覆盖一层致密的Fe3O4保护膜.
①完成并配平其反应的离子方程式:
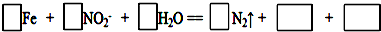
②如果有16.8g铁被钝化,则转移的电子数为4.82×1023(保留三位有效数字).
| A. | Cl2 | B. | HNO3 | C. | Na2O2 | D. | H2O2 |
| A. | 由一种元素组成的物质可能是混合物 | |
| B. | 能电离出氢离子的化合物不一定是酸 | |
| C. | 浊液、胶体、溶液的本质区别是分散剂粒子大小 | |
| D. | 电解质与非电解质的分类标准是化合物在水溶液或熔化状态下能否导电 |
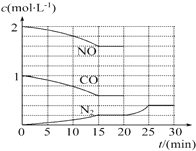 汽车尾气治理的方法之一是在汽车的排气管上安装一个“催化转化器”.
汽车尾气治理的方法之一是在汽车的排气管上安装一个“催化转化器”.