��Ŀ����
3����֪��N2��g��+3H2��g���T2NH3��g����H=-92.4kJ/mol�������Ϊ2L�ļס���������ͬ���ܱ�������һ���¶��£���������м���1mol N2��3mol H2������3min�ﵽƽ��ʱ�ų�Q1kJ�����������������м���2molNH3��һ��ʱ�䵽��ƽ��ʱ����Q2kJ����������֪Q1=3Q2����1���������������Ӧ�Ѵﵽƽ��״̬����AD
A�������ƽ����Է����������ٱ仯 B��ƽ�ⳣ�����ٱ仯
C�����������������백��������������� D������1molN��N����ͬʱ����6molN-H��
��2��Q2=23.1kJ
��3���������д�ƽ��ʱ��H2��ƽ����Ӧ����Ϊ0.03mol/��L•min������ƽ�������������м���0.25mol N2��0.75mol H2��1.5mol NH3��ƽ����ƶ�����Ϊ����Ӧ���������Ӧ�����淴Ӧ�����ƶ�����
���� ��1�����淴Ӧ����ƽ��ʱ��ͬ�����ʵ�����������ȣ�����ֵ�Ũ�ȡ��������ֲ��䣬�ɴ�����������һЩ�����䣬�ж�ƽ���������Ӧ�淴Ӧ���з����仯�����������ɱ仯�����仯˵������ƽ�⣻
��2��������Ϊ��ȫ��Чƽ�⣬ƽ��ʱ��ͬ��ֵ����ʵ�����ȣ��������ʼ���ʵ������ڻ�ѧ����������Q2+Q1=92.4�����ƽ��ʱQ1=3Q2����
��3��ƽ��ʱQ1=3Q2������Q2+Q1=92.4kJ����Q1=69.3kJ�������ת���ĵ���Ϊ$\frac{69.3kJ}{92.4kJ/mol}$=0.75mol����
N2��g��+3H2��g���T2NH3��g��
��ʼ����mol����1 3 0
ת������mol����0.75 2.25 1.5
ƽ������mol����0.25 0.75 1.5
����v=$\frac{��c}{��t}$����v��H2����
��ƽ�������������м���0.25mol N2��0.75mol H2��1.5mol NH3����ЧΪ��ԭƽ�����������ѹǿ��ƽ�������������С�ķ����ƶ���
��� �⣺��1��A������������������䣬�淴Ӧ���л���������ʵ��������仯���������ƽ����Է����������ٱ仯��˵������ƽ�⣬��A��ȷ��
B���¶Ȳ��䣬ƽ�ⳣ�����仯����B����
C�����������������백��������������ȣ�����ʾ�淴Ӧ���ʣ���Ӧʼ�հ��ñ�����ϵ���У���C����
D������1molN��N����ͬʱ����6molN-H����������1molN��N��������6molN-H��������������������������ȣ���Ӧ����ƽ�⣬��D��ȷ��
��ѡ��AD��
��2��������Ϊ��ȫ��Чƽ�⣬ƽ��ʱ��ͬ��ֵ����ʵ�����ȣ��������ʼ���ʵ������ڻ�ѧ����������Q2+Q1=92.4��ƽ��ʱQ1=3Q2���������Q2=23.1kJ��
�ʴ�Ϊ��23.1��
��3��ƽ��ʱQ1=3Q2������Q2+Q1=92.4kJ����Q1=69.3kJ�������ת���ĵ���Ϊ$\frac{69.3kJ}{92.4kJ/mol}$=0.75mol����
N2��g��+3H2��g���T2NH3��g��
��ʼ����mol����1 3 0
ת������mol����0.75 2.25 1.5
ƽ������mol����0.25 0.75 1.5
��v��H2��=$\frac{\frac{2.25mol}{2L}}{3min}$=0.375mol/��L��min����
��ƽ�������������м���0.25mol N2��0.75mol H2��1.5mol NH3����ЧΪ��ԭƽ�����������ѹǿ������ӦΪ���������С�ķ�Ӧ��ƽ��������У�
�ʴ�Ϊ��0.03������Ӧ����
���� ���⿼�黯ѧƽ����㣬��2����ע����ɵĹ����ܽᣬ��3����ע�����õ�Ч˼����Ҳ��������Ũ������ƽ�ⳣ����Դ�С�����жϣ��Ѷ��еȣ�

| A�� | ����-� ����-�ᡡ С�մ�-��ʽ�� | |
| B�� | ���-���� ����-����� ����-���� | |
| C�� | ������-����ʡ���CO2-���������� ��������Һ-���� | |
| D�� | ��ˮ-����ʡ� ���ᱵ-�ǵ���ʡ� �ƾ�-�л��� |
| A�� | CH4 | B�� | C2H6 | C�� | C4H8 | D�� | C2H4 |
| A�� | ���³�ѹ�£�2.24 L ˮ�з��ӵ���ĿΪ0.1 NA | |
| B�� | 0.1 mol•L-1�Ȼ����Һ�к��������ӵ���ĿΪ0.1 NA | |
| C�� | �����£�1.7 g�����к��е�����ĿΪ1.0 NA | |
| D�� | 10 g��������ԭ����ΪNA |
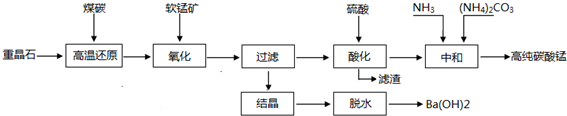

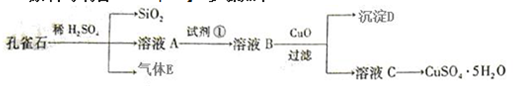
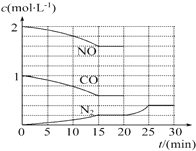 ����β�������ķ���֮һ�����������������ϰ�װһ������ת��������
����β�������ķ���֮һ�����������������ϰ�װһ������ת��������